Kenmerken van halogeen
Chemie / / July 04, 2021
Halogenen zijn de chemische elementen die zich in groep VIIA of groep 17 van het periodiek systeem bevinden. Het bestaat uit de elementen fluor, chloor, broom, jodium en astaat.
De naam halogeen komt uit het Grieks en betekent "producent van zouten", aangezien deze elementen zouten vormen met natrium met eigenschappen die vergelijkbaar zijn met gewoon zout.
Gemeenschappelijke kenmerken van halogenen:
Het zijn monovalente elementen, dat wil zeggen dat ze maar één valentiegetal hebben. In halogenen is de valentie -1.
Ze hebben affiniteit met waterstof en vormen de zogenaamde hydraciden.
Ze hebben weinig affiniteit voor zuurstof, waardoor ze bij zeer hoge temperaturen geen oxiden vormen.
Ze combineren met metalen om halogeenzouten te vormen.
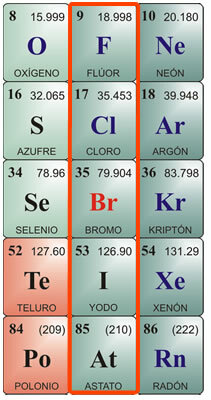
Individuele kenmerken van halogenen:
Fluorkenmerken::
Chemisch symbool F. Atoomnummer 9, atoomgewicht 19. Fluor in zijn zuivere staat is een geel gas, met een smeltpunt van -223°C en een kookpunt van -187°C. Het bestaat niet vrij in de natuur, dus het moet geïsoleerd worden. Het werd voor het eerst geïsoleerd in 1886. De fysieke kenmerken zijn: Groengeel gas, zeer bijtend en irriterend, met een penetrante geur, giftig voor mens en dier. Het is moeilijk vloeibaar te maken. Chemische eigenschappen: Het combineert met waterstof, zelfs bij zeer lage temperaturen met een exotherme reactie. Het combineert met metalen en vormt zouten. Het ontleedt zoutzuur, produceert chloor en ontleedt water, waarbij zuurstof vrijkomt. Vanwege zijn affiniteit voor waterstof, haalt het het uit organische stoffen en carboniseert het. Een van de belangrijkste verbindingen is fluorwaterstofzuur, dat alleen in platina- of waspotten kan worden bewaard, omdat het het silica in glas aantast. Het is zeer vluchtig en zeer corrosief. In combinatie met metalen produceert het fluoriden.
Chloorkenmerken::
Chemisch symbool Kl Atoomnummer 17, atoomgewicht 35.5. Smeltpunt - 102 ° C, kookpunt -37 ° C. Chloor werd ontdekt in 1774 en geïsoleerd in 1811. Fysische eigenschappen: Het is een groenachtig geel gas, dat niet vrij in de natuur voorkomt, omdat het over het algemeen in zouten wordt aangetroffen. Het heeft een verstikkende en giftige geur. Chemische eigenschappen: Chloor lijkt erg op waterstof en combineert in een exotherme reactie om zoutzuur te produceren. Zoutzuur, ook wel zoutzuur of rokend zout genoemd, was al bekend sinds het oude Rome. Het werd in gasvormige toestand gevonden in vulkanen en loste op in het water van sommige rivieren in de buurt van de vulkanen. Het is zeer bijtend voor de huid en giftig bij inslikken. Het wordt geproduceerd door de maag voor de spijsvertering. Andere belangrijke chloorverbindingen zijn hypochlorieten, vooral natriumhypochloriet, dat, wanneer opgelost in water, wordt gebruikt als waterbleekmiddel, ontsmettingsmiddel en sterilisator. Neutraliseert zuren.
Broom kenmerken:
Chemisch symbool Br Atoomnummer 35, atoomgewicht 79,9. Smeltpunt -7,3 ° C, kookpunt 58,8 ° C. Het komt niet vrij in de natuur voor, maar wordt gecombineerd met metalen om bromiden te vormen. Het wordt geïsoleerd door elektrolyse. Fysische eigenschappen: Het is een donkerrode vloeistof met een irriterende geur; geeft bij kamertemperatuur een irriterende dichte oranjerode damp af, die hoesten en tranen veroorzaakt; Het is giftig. Het lost op in ether of chloroform en lost nauwelijks op in water. Chemische eigenschappen: Broom tast organisch materiaal aan; bij levende wezens tast het de huid aan en veroorzaakt het zweren die moeilijk te genezen zijn. Het belangrijkste gebruik ervan wordt gecombineerd met metalen die bromiden vormen, die worden gebruikt voor industrieel gebruik, zoals zilverbromide, dat vroeger in de fotografie werd gebruikt. Ze worden ook in lage concentraties als antisepticum gebruikt. In combinatie met waterstof resulteert dit in broomwaterstofzuur, een kleurloos gas met een scherpe geur en smaak, dat voornamelijk wordt gebruikt om metalen aan te vallen en bromiden te verkrijgen.
Kenmerken van de Jodium:
Chemisch symbool I. Atoomnummer 53, atoomgewicht 126.9. Smeltpunt 113 ° C; kookpunt 184°C. Het bestaat niet vrij in de natuur. Het wordt aangetroffen in de vorm van jodiden in zeewierbedden en als onderdeel van de mineralen in sommige voedingsmiddelen, zoals waterkers, kabeljauwolie en schaaldieren. Fysische eigenschappen: Jodium is een vast, kristallijn lichaam, zwartachtig grijs van kleur, met een metaalachtige glans, met een sterke en onaangename geur. Het is slecht oplosbaar in water en zeer oplosbaar in alcohol. Chemische eigenschappen: Het combineert met metalen die jodiden vormen; ook met metalloïden, zoals zwavel en fosfor. Het heeft een hogere affiniteit voor zuurstof dan de andere halogenen. In combinatie met ammoniak produceert het stikstofjodide, een explosief gas. In combinatie met waterstof produceert het joodwaterstofzuur, een kleurloos gas met een scherpe geur en smaak, dat rookt in aanwezigheid van lucht. Het lost op in water en ontleedt onder invloed van licht en warmte. Als het zuurmolecuul zuurstof bevat, wordt ioïnezuur geproduceerd, een kristallijne vaste stof met oxiderende eigenschappen. Jodium wordt in alcoholische oplossingen gebruikt als ontsmettingsmiddel en antiseptisch middel.
Kenmerken van de Astatus:
Bij symbool. Atoomnummer 85, atoomgewicht 210. Het bestaat niet vrij in de natuur. Smeltpunt 254 ° C; kookpunt 962 °C. Astatine werd voor het eerst gesynthetiseerd in de jaren 1940, omdat het een element is dat vrijkomt bij de afbraak van bismutatomen door alfastralen. Het is een radioactief element met een zeer korte levensduur; de isotoop die het langst meegaat is At210, met een maximale levensduur van ongeveer 8 uur. De chemische eigenschappen ervan worden beschouwd als zeer vergelijkbaar met die van jodium; fysiek zou het een uiterlijk en eigenschappen kunnen hebben die meer lijken op die van metalen. Ondanks dat het een radioactief element is, vormt het geen gevaar voor de gezondheid, aangezien het normaal gesproken niet in de natuur voorkomt. Het heeft slechts een paar toepassingen in het laboratorium, voor het labelen van atomen in de studie van subatomaire materie.
