Voorbeeld van chemische elementen
Chemie / / July 04, 2021
Een chemisch element het is een zuivere stof die bestaat uit atomen van hetzelfde type, op zijn beurt gevormd door een aantal protonen en neutronen in de kern, en een hoeveelheid van elektronen in hun orbitalen. Sommige worden van nature gevonden, andere door de vorming van moleculen van een verbinding, en andere zijn gecreëerd door het uitvoeren van laboratoriumprocedures. Alle chemische elementen vormen de materie van het hele universum en ondersteunen het bestaan en functioneren van het menselijk lichaam.
Elk element heeft kenmerken en gedragingen die het onderscheiden en uniek maken, maar tegelijkertijd vertoont het overeenkomsten met een groep elementen in de manifestatie die ze hebben in de universum. Om deze reden is er het periodiek systeem van chemische elementen, dat deze overeenkomsten behandelt om de elementen coherent te groeperen en het gemakkelijker te maken om hun eigenschappen te bestuderen.
Atoomnummer van een element
het atoom draagt in de kern een aantal protonen, vergezeld van hetzelfde aantal neutronen
. Naar dit nummer het wordt het atoomnummer genoemd, weergegeven als Z voor academische doeleinden en in de literatuur. Voor elk Element is dit nummer uniek. Er zijn geen twee elementen met hetzelfde atoomnummer. Het periodiek systeem richt zich ook op dit criterium om ze te ordenen.Symbool van een element
In de tijd van de alchemie, die ongeveer het jaar 400 tot 1000 na Christus omvat. C., hebben de alchemisten hun experimenten vastgelegd door symbolen aan de elementen toe te kennen. Het waren eenvoudige symbolen, gemaakt met geometrische figuren, om het individuele element en de bestudeerde transformaties weer te geven.
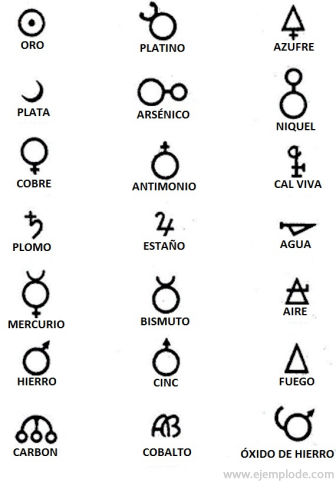
Enkele voorbeelden van alchemistische symbolen, met de naam van het element of de verbinding die ze vertegenwoordigden.
In het tijdperk van de moderne scheikunde worden de elementen nog steeds weergegeven met symbolen, in dit geval letters die in het Latijn of Engels naar hun naam verwijzen.
Bijvoorbeeld:
Het symbool voor natrium is nee, door zijn Latijnse naam Natrium
Het symbool van goud is Au, door zijn Latijnse naam Aurum
Het symbool voor zilver is Ag, door zijn Latijnse naam Argentum
Het symbool voor koper is Cu, door zijn Latijnse naam Cuprum
Het symbool van Antimoon is sb, door zijn Latijnse naam Stibium
Het symbool van ijzer is Geloof, door zijn Latijnse naam Ferrum
Het symbool van Mercurius is Hg, door zijn Latijnse naam Kwik, wat "vloeibaar zilver" betekent
Het symbool voor kalium is K, door zijn Latijnse naam Kalium
Chemische elementengroepen:
Het periodiek systeem van chemische elementen classificeert deze in groepen: groepen A en groepen B. Groepen A zijn acht, die de Elementen bevatten Alkalisch, de Alkalisch-aards, de Terreos, drie families van Elementen, waarvan het hoofd de naam van de familie definieert: Koolstoffamilie, Stikstof familie, Zwavel Familie, de Halogenen en de Edelgassen. Groepen B bestaan uit alle all Overgangsmetalen en de Rare Earths, die ook twee grote families zijn: Lanthanidenide Y actiniden.
Groep IA: Alkalische elementen:
De reeks alkalische elementen bestaat uit waterstof (H), lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) en Francium (Fr). Ze hebben allemaal een elektronische configuratie zodat ze in de laatste schil een elektron hebben. Hun naam is te danken aan het feit dat wanneer ze in contact komen met water, ze reageren om alkaliën of hydroxiden te vormen. Het is een algemeen gedrag tussen deze elementen. Hoe groter het atoom van het element, hoe reactiever het is, aangezien de kracht waarmee de kern het elektron uit de laatste schil vasthoudt steeds minder reikwijdte heeft. Ze zijn in staat om ionische bindingen te vormen met halogenen. Bijvoorbeeld: de ionische binding die overvloedig aanwezig is, is die van natrium-chloor, waardoor natriumchloride wordt gevormd NaCl.
Groep IIA: Aardalkali-elementen:
Deze elementen zijn: Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) en Radium (Ra). Ze zijn niet vrij van aard; in plaats daarvan bestaan de carbonaten en silicaten in relatieve overvloed. Ze zijn Argentijns wit en kristallijn. Ze combineren gemakkelijk met zuurstof als ze worden blootgesteld aan lucht. Dit is gedeeltelijk te wijten aan het feit dat ze twee elektronen in hun laatste schil hebben, in overeenstemming met de zuurstofopnamecapaciteit. Barium is het meest actieve element van de groep en samen met Calcium zijn het degenen met de meeste industriële toepassingen in de groep.
Groep IIIA: Aardelementen:
Groep IIIA omvat de elementen Borium (B), Aluminium (Al), Gallium (Ga), Indium (In) en Thallium (Tl). Borium is een niet-metalen element, aluminium is amfoteer (amfiprotisch), dat wil zeggen dat het in staat is om als zuur en als base te werken; en de andere drie zijn metalen elementen. Ze hebben drie elektronen in hun laatste schil, die een valentie van +3 genereren, hoewel Gallium soms werkt met een +1 en +2 valentie in sommige van zijn verbindingen. Borium is het enige element in deze serie dat Hydrides vormt. Borium en aluminium vormen carbiden.
Groep IVA: Koolstoffamilie:
De representatieve elementen van groep IVA zijn Koolstof (C), Silicium (Si), Germanium (Ge), Tin (Sn) en Lood (Pb). De eerste twee zijn fundamenteel niet-metaalachtig in hun kenmerken, maar germanium, tin en lood zijn metallisch, en des te meer naarmate hun atoomnummer hoger is. Met uitzondering van Silicium heeft elk element de valenties +4 en +2.
Koolstof en silicium vormen verbindingen waarin atomen van de elementen zijn verbonden door paren gedeelde elektronen. Koolstof is de essentie van organische verbindingen door te associëren met atomen van waterstof, zuurstof, stikstof, zwavel en soms silicium.
Silicium en Germanium worden gebruikt voor de vervaardiging van elektronische componenten, omdat ze de eigenschap hebben zich als halfgeleiders te gedragen.
Groep VA: Stikstoffamilie:
Groep VA omvat de elementen Stikstof (N), Fosfor (P), Arseen (As), Antimoon (Sb) en Bismut (Bi). Stikstof en fosfor zijn niet-metaalachtig, arseen en antimoon zijn metalloïden en bismut is een metaal. Deze elementen worden gekenmerkt door de vorming van hydriden, waarvan de minst giftige ammoniak NH. is3. Stikstof vormt salpeterzuur HNO3, samen met zoutzuur betrokken in Agua Regia, een mengsel dat edele metalen zoals goud en zilver kan oplossen.
Stikstof is ook betrokken bij twee grote groepen organische verbindingen, amines en amiden genaamd, die kunnen worden beschouwd als derivaten van ammoniak NH3, door vervanging van een waterstof door een koolwaterstofketen.
Groep VIA: Zuurstoffamilie:
Bestaat uit de elementen Zuurstof (O), Zwavel (S), Selenium (Se), Tellurium (Te) en Polonium (Po). Zuurstof is het meest actief en heeft het vermogen om gemakkelijk covalente bindingen te vormen. In contact met metalen in een omgeving met een hoge luchtvochtigheid vormt het oxiden. Het vormt een resonant molecuul genaamd ozon, dat de planeet beschermt tegen UV-straling.
Groep VIIA: Halogenen:
De naam betekent "Sales Formers". De groep bestaat uit de elementen Fluor (F), Chloor (Cl), Broom (Br), Jodium (I) en Astaat (At). Ze hebben zeven elektronen in de laatste schil, waardoor ze receptoren kunnen zijn voor één elektron. Door deze kwaliteit zijn ze verbonden met de elementen van groep IA en vormen ze binaire zouten. Fluor wordt gekenmerkt door de grootste elektronegativiteit van het gehele periodiek systeem, met een waarde van 4,0, met als tegenhanger Cesium, met elektronegativiteit van 0,7. Deze eigenschap stelt het in staat om de kracht te hebben om andere atomen aan te trekken en prioriteit te geven aan het vormen van een band met ze.
Groep VIIIA: Edelgassen:
Het wordt ook wel de Inert Gas Group genoemd en bestaat uit de elementen Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) en Radon (Ra). Het zijn de elementen die al hun volledige elektronische configuratie hebben, dus ze zijn niet in staat om onder normale omstandigheden te reageren. Ze worden voornamelijk gebruikt voor lichtgevende reclameborden, die zichtbaar licht uitstralen wanneer er een elektrische stroom op invalt.
Groepen B: Overgangsmetalen:
In tien groepen van elk drie elementen zijn de overgangsmetalen gegroepeerd. Deze omvatten de beste elektrische geleiders: zilver (Ag), koper (Cu), goud (Au); de beste structurele componenten voor stedelijke constructie en engineering; IJzer (Fe), titanium (Ti), aluminium (Al), zirkonium (Zr), wolfraam (W); de beste katalysatorcomponenten: Nikkel (Ni), Vanadium (V), Platina (Pt); en de belangrijkste coatingingrediënten: cadmium (Cd), chroom (Cr), zink (Zn). Ze verwerken meestal valenties tussen +1 en +3, maar elementen zoals Chromium verwerken de valenties +2, +3, +6.
Zeldzame aardmetalen: lanthaniden en actiniden:
Ze worden zeldzame aardes genoemd vanwege hun schaarste op de planeet. Ze bestaan uit twee groepen: lanthaniden en actiniden. Ze zijn te vinden op de twee afzonderlijke regels van het periodiek systeem. Ze werken in het algemeen met een valentie van +3 en hebben de neiging hydroxiden te vormen. Het belangrijkste element daarvan is Cerium, dat wordt gebruikt bij de bereiding van pyrofore legeringen (Alloy Mischmetal, voor stenen voor aanstekers), in gasslangen voor verlichting en bij de vervaardiging van speciale glazen die ultraviolette stralen en warmtestraling absorberen.
De krachtigste radioactieve elementen, zoals uranium (U) en plutonium (Pu), maken deel uit van deze groepen. die, gezien hun instabiliteit, energie vrijgeven en uiteenvallen, waarbij alfadeeltjes (kernen van Helium). Later worden het minder instabiele elementen, zo blijkt uit de radioactieve reeks.