Voorbeeld van chemische energie
Chemie / / July 04, 2021
De Chemische energie is dat wat voortkomt uit chemische reacties. De interactie tussen chemische soorten genereert breuk en / of vorming van bindingen, wat respectievelijk een afgifte of absorptie van energie impliceert. Chemische energie wordt de vrijgekomen energie genoemd, die bijvoorbeeld kan worden gebruikt als thermische energie en elektrische energie.
Energie in chemische reacties
Chemische energie kan in zijn maximale expressie worden verkregen uit twee hoofdbronnen: verbrandings- en elektrolytische oplossingen. Aan de andere kant is het op het niveau van het menselijk lichaam mogelijk om energie te verkrijgen door de chemische desintegratie van voedsel.
Verbrandingsenergie
Wanneer bijvoorbeeld de brandstofmethaan CH4, de eenvoudigste koolwaterstof, begint te branden in aanwezigheid van de zuurstofoxidator, het zal desintegreren en kooldioxide-CO-producten vormen.2 en water H2OF. Bovendien komt bij het verbreken van de bindingen van de waterstofatomen met de koolstofatomen energie vrij in de vorm van warmte.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 Kcal / mol
Methaanverbrandingsvergelijking. De warmte van deze reactie wordt weergegeven door ΔH. Het negatieve teken geeft aan dat er energie vrijkomt. De reactie is exotherm.
 Verbranding van methaangas. De reactie manifesteert zich met een vlam.
Verbranding van methaangas. De reactie manifesteert zich met een vlam.
Voorbeelden van verbrandingswarmte van organische verbindingen bij 25 ° C.
verbinding |
Formule |
ΔH (Kcal / mol) |
Methaan (g) |
CH4 |
-212.80 |
ethaan (g) |
C2H6 |
-372.82 |
Propaan (g) |
C3H8 |
-530.60 |
n-Butaan (g) |
C4H10 |
-687.98 |
n-pentaan (g) |
C5H12 |
-845.16 |
Ethyleen (g) |
C2H4 |
-337.23 |
Acetyleen (g) |
C2H2 |
-310.62 |
benzeen (g) |
C6H6 |
-787.20 |
benzeen (l) |
C6H6 |
-780.98 |
Tolueen (l) |
C7H8 |
-934.50 |
Naftaleen(en) |
C10H8 |
-1,228.18 |
Sacharose(s) |
C12H22OF11 |
-1,348.90 |
Methanol (l) |
CH3Oh |
-173.67 |
Ethanol (l) |
C2H5Oh |
-326.70 |
Azijnzuur (l) |
CH3COOH |
-208.34 |
Benzoëzuur(en) |
C6H5COOH |
-771.20 |
Om ervoor te zorgen dat een brandstof alle verbrandingswarmte kan leveren waartoe het in staat is, moet het zich in een gasvormige toestand bevinden. Zoals te zien is in de tabel, draagt vloeibaar benzeen een verbrandingswarmte bij die 6,22 Kcal/mol minder is dan die die vrijkomt bij gasvormig benzeen. Dit betekent dat er 6,22 Kcal/mol geïnvesteerd moet worden om de overstap van vloeibaar naar gas te maken.
Klik voor meer informatie over de brandstoffen.
Elektrolytische oplossingen Energie
Een elektrolytische geleider is een medium waarin een of meer ionensoorten zijn betrokken, namelijk: verspreid met zijn elektrische lading, waardoor de doorgang van een elektrische stroom door zijn Grondwet. Elektrolytische oplossingen zijn elektrolytische geleiders.
Elektrolytische geleiders omvatten, naast elektrolytoplossingen, Gesmolten zouten, en ook enkele vaste zouten, zoals natriumchloride NaCl en zilvernitraat AgNO3.
De overdracht van elektronen vindt plaats door ionische migratie, positief en negatief, naar de elektroden. Deze migratie omvat niet alleen een overdracht van elektriciteit, maar ook het transport van materie van het ene deel van de geleider naar het andere.
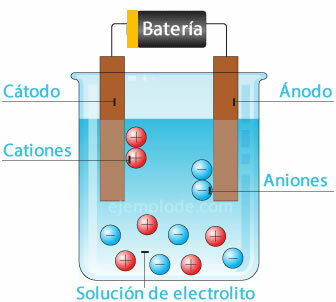 Elektrochemische cel
Elektrochemische cel
Een potentiaalbron aansluiten op de metalen elektroden (kathode en anode) en deze onderdompelen in een Waterige oplossing, de elektronen zullen door de anode reizen om van de oplossing naar de positieve pool van de te ontsnappen fontein. Dit is bijvoorbeeld het geval met een chloride-ion, dat vrijkomt uit zijn elektron, en al met een neutrale lading, voegt het zich bij een ander chlooratoom om het diatomische molecuul te vormen. Chloorgas zal uit de oplossing ontsnappen.
2Cl- = 2Cl + 2e-
Elektronen die de negatieve pool van de bron verlaten, worden ondergebracht in de ondergedompelde kathode. De soorten die in de waterige oplossing (ionen) aanwezig zijn, nemen de elektronen van de kathode. Bijvoorbeeld, de waterstofionen waaruit water bestaat, omdat ze een positieve lading hadden, namen een elektron dat moet worden geneutraliseerd en samengevoegd met een ander waterstofatoom om het molecuul te vormen diatomisch. Het zal als waterstofgas uit de oplossing ontsnappen.
2H+ + 2e- = 2H
2H = H2 (g)
Deze uitwisseling van elektronen kan de werking van autobatterijen ondersteunen, die bestaan uit lood-Pb-elektroden die zijn ondergedompeld in een oplossing van zwavelzuur H2SW4.
Dezelfde energie wordt verkregen in alle soorten batterijen die op huishoudelijk niveau worden gebruikt: 9V, AA, AAA, D, om maar een paar voorbeelden te noemen.
Voedsel Energie
Mensen nemen de energie op die vrijkomt door het voedsel dat we in ons lichaam eten te desintegreren. Deze energie is wat ons lichaam gebruikt voor niet-bewuste functies (spijsvertering, hartslag, cellulaire functies) en die we uitvoeren.
Zolang u niet intensief aan lichaamsbeweging doet en uw stofwisseling traag is, is het raadzaam om regelmatig calorieën in te nemen, omdat voedingsmiddelen met een hoog lipiden en complexe koolhydraten, die zeer grote structuren hebben, zijn moeilijker af te breken, wat resulteert in een omkering van Energie. In dat geval zou het effect even tegengesteld zijn.
Het is raadzaam om fruit te consumeren als je 's nachts moet werken, omdat het fruit fructose bevat, een eenvoudig koolhydraat dat gemakkelijk af te breken is en na uw consumptie.
Chemische energie en zijn transformaties
Thermo-elektrische centrales
In thermo-elektrische centrales worden zware brandstoffen gebruikt om een hoge en langdurige calorische waarde te hebben. Over het algemeen is het stookolie (stookolie). Verbranding, de chemische fase van het proces, zal dienen als verwarmingsmiddel voor een ketel, die verzadigde stoom zal genereren. Deze stoom zal onder druk via het stoomdistributienetwerk naar buiten komen en de turbines van de generatoren gaan bewegen. Deze apparaten zullen elektrische energie produceren om de overeenkomstige bevolking van stroom te voorzien.
Chemische energie → Mechanische energie → Elektrische energie
Automobielbedrijf
Auto's zijn afhankelijk van een stroombron, namelijk de batterij. Het is al bekend dat in de accu elektrolytische geleiding optreedt, die het ontstekingssysteem, dashboardaccessoires en extra stopcontacten van stroom voorziet. Dankzij deze beschikbare elektriciteit kan de auto zich verplaatsen om de bestuurder naar de gewenste locatie te brengen.
Chemische energie → Elektrische energie → Mechanische energie


