Wat is elektrolyse?
Chemie / / July 04, 2021
In de chemie, elektrolyse is het fenomeen waarin een elektrische stroom loopt door een waterige oplossing van een ionische verbinding, en begint richt de ionen (geladen deeltjes) van verbinding a twee elektroden, positief (anode, trekt negatief geladen anionen aan) en negatieve (Kathode, trekt positief geladen kationen aan). Dit fenomeen wordt beheerst door de wet van elektrostatica, die aangeeft dat tegengestelde ladingen elkaar aantrekken.
elektrolyten
In 1883, Michael faraday ontdekte dat waterige oplossingen van bepaalde stoffen elektrische stroom geleiden, terwijl oplossingen van andere stoffen dat niet doen.
Om te testen of een waterige oplossing elektrische stroom geleidt, ontwierp Faraday een eenvoudig apparaat dat bestaat uit een 110 volt gelijkstroomcircuit, een lamp, ja twee metalen of grafietelektroden aangesloten naar de huidige bron.
Als de elektroden in water worden ondergedompeld, is de hoeveelheid stroom die vloeit zo klein dat de lamp niet oplicht; hetzelfde geldt als ze in een suikeroplossing worden gedompeld.
Integendeel, als ze worden ondergedompeld in een oplossing van Natriumchloride NaCl of van Zoutzuur HCl, de lamp schijnt fel, wat bewijst dat de ontbinding is een uitstekende geleider. Aan de andere kant, met behulp van azijnzuur CH3Geconcentreerd COOH, de oplossing geleidt de stroom slecht, maar wanneer het zuur wordt verdund met water H2Of de elektrische geleidbaarheid neemt toe.
Tijdens de stroomdoorgang door verschillende oplossingen worden verschillende producten aan de elektroden verkregen.
Tijdens zijn studie over elektrolyse heeft Faraday de volgende wetten afgeleid:
1e wet: De hoeveelheid stof die zijn chemische transformatie in een elektrode heeft, is evenredig met de hoeveelheid elektriciteit die door de oplossing gaat.
2e wet: Als dezelfde hoeveelheid elektriciteit door verschillende oplossingen wordt geleid, zijn de gewichten van de stoffen ontbonden of afgezet op de verschillende elektroden zijn evenredig met de equivalente gewichten van de genoemde stoffen.
Om een voorbeeld te noemen:
Er wordt van uitgegaan dat u vijf verschillende elektrolysecellen heeft. de eerste met Zoutzuur HCl, de tweede met Kopersulfaat CuSO4, de derde met Antimoonchloride SbCl3, de vierde met Stannochloride SnCl2 en de vijfde met Stannichloride SnCl4.
Dezelfde stroom wordt door een reeks elektrolytische cellen geleid, totdat 1008 gram waterstof is vrijgekomen (a Equivalent gewicht van waterstof) van de zoutzuuroplossing, de gewichten (in grammen) van de andere producten die in dezelfde tijd vrijkomen Zij zijn:
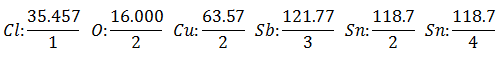
De Gelijkwaardig gewicht heeft de waarde van Atoomgewicht van het element gedeeld door het Valencia van het element.
Om een gelijkwaardig gewicht van een item vrij te geven, heb je nodig: 96500 Coulombs. Deze hoeveelheid elektriciteit heet 1 Faraday.
De Faraday-eenheid
Ampere wordt gedefinieerd als een uniforme stroom die 0,001118 gram zilver (Ag) afzet uit een oplossing van zilvernitraat (AgNO3) in een seconde. Aangezien het atoomgewicht van zilver 107,88 g / mol is, de verhouding 107,88 / 0,001118 geeft de aantal Ampère-seconden of Coulombs elektriciteit nodig om een chemisch equivalent van zilver te deponeren. Deze hoeveelheid is 96494 Coulombs (de waarde van 96500 is redelijk bij benadering voor eenvoudigere berekeningen), en wordt 1 Faraday van elektriciteit genoemd.
Elektroden
Faraday belde Anode naar positieve elektrode en kathode naar negatieve elektrode. Hij creëerde ook de termen Anion en Kation, toegepast op de stoffen die respectievelijk aan de anode en aan de kathode verschijnen tijdens elektrolyse.
Momenteel is een andere definitie voor elektroden:
anode: Elektrode waarin sprake is van verlies van elektronen of oxidatie.
Kathode: Elektrode waarin sprake is van elektronenversterking of -reductie.
Elektrolyten en niet-elektrolyten
De geleiding van elektrische stroom door oplossingen werd pas in 1887 bevredigend verklaard, toen Svante Arrhenius zijn theorie bekendmaakte. Voordat we de theorie van Arrhenius waarderen en begrijpen, hebben we eerst enkele feiten uiteengezet die de wetenschap kende toen Arrhenius deze formuleerde:
De Oplossingen zonder elektrolyten ze hebben eigenschappen die kunnen worden berekend door de wet van Raoult toe te passen. De dampdrukken en de waargenomen kook- en vriespunten van deze oplossingen zijn praktisch gelijk aan de berekende waarden.
De De wet van Raoult legt uit dat de dampdruk van elke opgeloste stof in oplossing afhangt van zijn eigen molfractie erin, vermenigvuldigd met zijn dampdruk in zuivere staat.

De wet van Raoult faalt wanneer toegepast op elektrolytoplossingen in water. De variaties van de dampdruk en van het kook- en vriespunt zijn altijd groter dan die voorspeld door de bovengenoemde wet, en bovendien nemen ze toe bij verdunning.
Dergelijke afwijkingen worden weergegeven door de waarde i, die de verhouding is van de waargenomen variatie in het vriespunt en de variatie berekend in het vriespunt:

De waarde van i is een maat voor de afwijking van de wet van Raoult en is gelijk aan 1 als er geen afwijking is.
Elektrische geleidbaarheid van elektrolyten
Arrhenius onderzocht de geleidbaarheid van waterige elektrolytoplossingen om erachter te komen hoe de geleidbaarheid varieerde met de elektrolytconcentratie.
Het mat de molaire geleidbaarheid (wat de geleidbaarheid is die overeenkomt met één mol opgeloste elektrolyt; dat wil zeggen, de specifieke geleidbaarheid verwees naar één mol, en vond dat deze toenam met verdunning.
Arrhenius vergeleek zijn resultaten met metingen van afwijkingen van de wet van Raoult, en vond een nauw verband tussen deze en molaire geleidbaarheid. In zijn theorie wordt het gedrag van elektrolyten verklaard:
“Elektrolytmoleculen dissociëren in elektrisch geladen deeltjes die ionen worden genoemd. De oplossing is onvolledig en er is een evenwicht tussen de moleculen en hun ionen. De ionen geleiden de stroom terwijl ze in de oplossing bewegen ”.
Afwijkingen van de wet van Raoult zijn te wijten aan de toename van het aantal deeltjes als gevolg van de gedeeltelijke dissociatie van de moleculen.
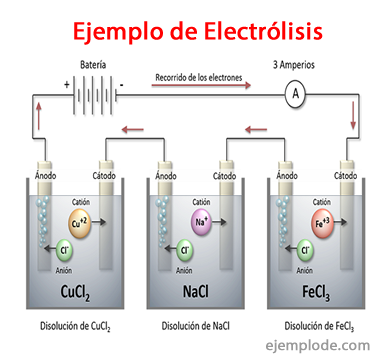
Voorbeelden van elektrolyse
Sommige oplossingen die zich gedragen als elektrolyten, dat wil zeggen dat ze de capaciteit hebben voor elektrolyse, zijn:
Natriumchloride NaCl
Zoutzuur HCl
Natriumsulfaat Na2SW4
Zwavelzuur H2SW4
Natriumhydroxide NaOH
Ammoniumhydroxide NH4Oh
Natriumcarbonaat Na2CO3
Natriumbicarbonaat NaHCO3
Salpeterzuur HNO3
Zilvernitraat AgNO3
Zinksulfaat ZnSO4



