Voorbeeld volumetrische analyse Analysis
Chemie / / July 04, 2021
Aan Analytische chemie, de volumetrie is een analysemethode die bestaat uit de Meting van het volume reagens dat nodig is om stoichiometrisch te reageren met de analyt, wat de stof is die moet worden bepaald.
Stoichiometrisch reageren verwijst naar de stoffen die chemisch op elkaar inwerken, volgens de deel dat de chemische vergelijking markeert al in balans.
De te onderzoeken stof heet analyt. Van deze stof zal een bekend en exact gemeten volume als monster worden genomen, dat we zullen noemen Hoeveelheid, in een erlenmeyer om de analyse te beginnen.
Concepten van volumetrische analyse
Volumetrische analyse, een soort van Chemische analyse, dragen een chemische reactie betrokken. Deze chemische reactie wordt uitgevoerd tussen het monster met een onbekende hoeveelheid van de onderzochte stof en een bekende hoeveelheid van een andere stof die in staat is om met de eerste te reageren.
De Reactiestoffen bevinden zich in een waterige oplossing, en de volumes oplossingen die interactie hebben gehad om het einde van de reactie te bereiken, zullen worden gemeten, wat zichtbaar zal zijn dankzij een indicator die kleur in de kolf zal geven.
In volumetrische analyse, de waterige oplossing van Bekende concentratie wordt standaardoplossing genoemd, Standaard of Titrant, en zal dienen als referentie voor het beëindigen van de reactie, om de berekening te maken die de hoeveelheid van de onderzochte stof zal onthullen.
Deze procedure om beide oplossingen te laten reageren heet Chemische graad o Waardering, het fundamentele onderdeel van volumetrische analyse. Bestaat uit gaan geleidelijk gieten van de standaardoplossing (titrant) in de hoeveelheid (Voorbeeld), totdat de indicator de verandering met een kleurverschil aangeeft.
EEN Indicator Het is een chemische stof die aan het Aliquot wordt toegevoegd, een kleur vertoont en die, wanneer de reactie eindigt, van kleur verandert.
Een volumetrische analyse bestaat uit een eenvoudige reeks stappen:
1.- Bereiding van standaardoplossing
2.- Voorbereiding van het monster of aliquot
3.- Chemische graad:
4.- Volumemeting
5.- Berekening van de onderzochte stof.
Tot het punt waar ze al hebben volledig gereageerd de twee stoffen, wordt het genoemd Equivalentiepunt.
Zoals bij elke chemische analysemethode, zijn er bij volumetrische analyse vereisten voor goede resultaten:
-De chemische reactie moet zijn: Selectief, dat wil zeggen, de standaardoplossing zal alleen reageren met het monster.
-De chemische reactie moet zijn: Stoichiometrisch, dat wil zeggen, om de verhoudingen te gehoorzamen die zijn gemarkeerd in de uitgebalanceerde chemische vergelijking.
-De chemische reactie moet zijn: Kwantitatief; verwijst naar 99,9% voltooiing op het equivalentiepunt.
-Er moet een zijn detecteerbaar eindpunt in reactie, wat beter wordt bevestigd door de indicator.
Primair patroon
De Primaire patronen Het zijn stoffen van hoge zuiverheid waarvan de concentratie in oplossing direct wordt berekend uit de gewogen hoeveelheid en het gebruikte volume water.
A) Ja, kan worden gereageerd met werkende oplossingen, om de concentraties van deze laatste te kennen en om te zetten in standaardoplossingen.
Voorbeelden van primaire patronen zijn:
-Natriumcarbonaat (Na2CO3): Gebruikt om zuren te standaardiseren, zoals zwavelzuur.
-Kaliumbiftalaat: het is de primaire standaard om standaardoplossingen van basen, zoals natriumhydroxide, te bereiden.
-Natriumchloride (NaCl): het wordt gebruikt om zilvernitraatoplossingen te standaardiseren.
-Calciumcarbonaat (CaCO3): Primaire standaard voor EDTA (ethyleendiaminetetraazijnzuur).
Een primair patroon moet aan een aantal essentiële kenmerken voldoen:
Moet een hebben Hoge zuiverheid, Atmosferische stabiliteit, Afwezigheid van hydratatiewater, Lage kosten en gemakkelijk te verkrijgen, ja Hoog equivalent gewicht.
Classificatie van volumetrische analyse
Afhankelijk van de chemische soort waarmee je werkt om een analyse te maken, zal het het type volumetrie zijn:
Volumetrie op zuurbasis: Het werkt, met een zuur of met een base, om monsters te analyseren die zuren of basen bevatten.
Neerslagvolumetrie: Ook wel Argentometrie genoemd, het gebruikt een standaardoplossing van zilvernitraat om te bepalen hoeveel chloriden er in een monster zitten.
Complexiteit Volumetrie: Een standaardoplossing van een complexvormer, zoals EDTA, wordt gebruikt om de concentratie van hardheid, dat wil zeggen calcium- en magnesiumcarbonaat, in het water te meten.
REDOX volumetrie: De reactie vindt plaats tussen een oxiderende stof en een reducerende stof.
Indicatoren
Van de talrijke indicatoren die in Volumetrics worden gebruikt, springen er drie uit:
1.- Methyl oranje: Het duurt een oranje kleuring in het aliquot, dat zal worden getitreerd met een zuur. Wanneer het equivalentiepunt is bereikt, wordt de indicator geel.
2.- Fenolftaleïne: Het is in het begin transparant in het aliquot, dat een titel krijgt met een basis. Wanneer het equivalentiepunt is bereikt, wordt de indicator roze.
3.- Eriochroom Zwart: Het is de indicator die wordt gebruikt om de hardheid in water te bepalen. In het begin is het paars in het aliquot, totdat het wordt getitreerd met een complexvormer. Aan het einde van de reactie wordt het blauw.

Instrumenten in een volumetrische analyse
Bij een Volumetrische Analyse wordt een reeks instrumenten gebruikt die, als ze niet beschikbaar zijn, niet adequaat kunnen worden ontwikkeld:
1.- Maatkolf: het is een container als een bol in het onderste deel, afgeplat aan de onderkant, die een dunne kolom heeft waarin de vloeistof wordt toegevoegd. Het heeft een markering om aan te geven waar de meniscus van de vloeistof moet zijn, zodat het het exacte volume bedekt. Het wordt gebruikt om standaardoplossingen te bevatten; dankzij de nauwkeurigheid van het volume is een bekende concentratie verzekerd.

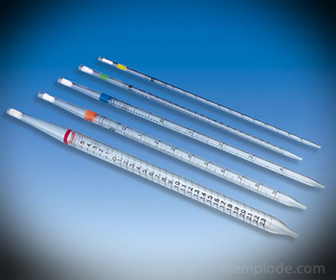
2.- Pipetten: dit zijn dunne buisjes met schaalverdeling waarmee op betrouwbare wijze exacte hoeveelheden vloeistof kunnen worden gemeten. Ze zijn verkrijgbaar tot 25 milliliter en maken nauwkeurige monstername mogelijk.
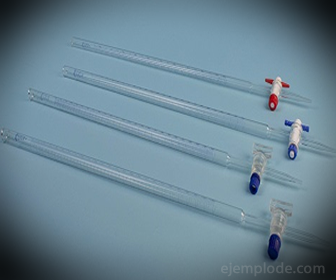
3.- Buret: Het is een langwerpige buis met een inhoud van 50 milliliter, die de standaardoplossing zal bevatten. Aan een van de uiteinden heeft het een stroomregelklep die de oplossing in het aliquot laat lopen.
4.- Erlenmeyerkolven: Het zijn containers met een platte bodem, conische vorm die eindigt in een cilindrische rand. Dit ontwerp maakt ze geschikt voor chemische titraties, omdat ze het schudden van de oplossingen niet laten overstromen. Er zijn er minimaal drie nodig als herhaalde tests moeten worden uitgevoerd, om een betrouwbaar resultaat te garanderen.

Berekeningen in een volumetrische analyse
Aangezien waterige oplossingen worden gehanteerd, zijn de hoeveelheden die van belang zijn voor een volumetrische analyse Concentratie en Volume.
De hoofdvergelijking van volumetrie is gebaseerd op vier hoofdgegevens:
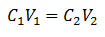
C1= Monsterconcentratie (onbekend)
V1= Volume van het Aliquot, waarmee aan de analyse is gewerkt
C2= Concentratie van standaardoplossing gebruikt om het equivalentiepunt te bereiken
V2= Volume Standaardoplossing nodig om het einde van de reactie te bereiken
De gegevens worden in de vergelijking gesubstitueerd, waardoor alleen de gezochte concentratie onbekend blijft. Natuurlijk moeten alle gegevens op dezelfde schijven staan.
Voorbeelden van volumetrische analyse
Bepaling van chloriden (Cl-) door Argentometrie, met zilvernitraat.
Bepaling van bromiden (Br-) door Argentometrie, met zilvernitraat.
Bepaling van cyaniden (CN-) door Argentometrie, met zilvernitraat.
Bepaling van magnesiumcarbonaat (MgCO3), door Complexometrie, met EDTA.
Bepaling van calciumcarbonaat (CaCO3), door Complexometrie, met EDTA.
Zwavelzuuranalyse (H2SW4) met natriumhydroxide (NaOH).
Analyse van natriumhydroxide (NaOH) met zoutzuur (HCl).
Bepaling van antimoon (III) met kaliumpermanganaat (KMnO4).
Bepaling van arseen (III) met kaliumpermanganaat (KMnO4).
Bepaling van titanium (III) met kaliumpermanganaat (KMnO4).
Bepaling van Molybdeen (III) met Kaliumpermanganaat (KMnO4).
Bepaling van ijzer (II) met kaliumpermanganaat (KMnO4).
Bepaling van oxalaat-ionen met kaliumpermanganaat (KMnO4).