Voorbeeld van de wet van Dalton
Chemie / / July 04, 2021
De Engelse wetenschapper John Dalton (1766-1844) was een natuurkundige en scheikundige die veel heeft bijgedragen aan de compressie en classificatie van de elementen en chemicaliën. Een van zijn belangrijkste bijdragen is het eerste model voor de weergave van atomen en verbindingen door middel van een grafische weergave. Hij formuleerde ook de zogenaamde "Law of Multiple Proportions", ook wel de wet van Dalton genoemd.
Over chemische combinaties formuleerde Louis Proust (1754-1826) de "Wet van constante proporties", waarin hij verzamelt de observatie dat chemicaliën altijd in dezelfde verhouding combineren om dezelfde verbindingen te produceren. Dat wil zeggen, als waterstof en zuurstof worden gecombineerd, zullen ze altijd in dezelfde verhoudingen worden gecombineerd om water te produceren. Deze wet legde echter niet uit hoe er verschillende verbindingen waren die uit dezelfde stoffen bestonden.
Met zijn atoomtheorie realiseerde Dalton zich dat wanneer sommige eenvoudige stoffen worden gecombineerd, ze kunnen verschillende verbindingen worden geproduceerd en dat de hoeveelheden van een van de stoffen in een evenredige verhouding variëren gemakkelijk.
De wet van Dalton wordt als volgt uitgedrukt: De gewichten van een element die samenkomen met dezelfde hoeveelheid van een ander om verschillende chemische verbindingen te vormen, variëren volgens een zeer eenvoudige relatie.
Dit betekent dat als we weten hoe stoffen in eenvoudige verhoudingen worden gecombineerd, en de hoeveelheid van een van de stoffen constant blijft en een andere stof die we in een eenvoudige verhouding plaatsen, in een verhouding van 2, 3 of 4 ten opzichte van de oorspronkelijke verhouding, in elk geval krijgen we een stof anders. Dit gebeurt bijvoorbeeld bij het combineren van fosfor, waterstof en zuurstof.
Als we 1 volume fosfor, 3 volumes waterstof en 2 volumes zuurstof combineren, krijgen we hypofosforzuur:
P + 3H + 2O -> PO2H3
Als we in de vorige reactie alleen de zuurstof in een eenvoudige verhouding van 2 variëren, krijgen we fosforzuur:
P + 3H + 4O -> PO4H3
Er moet rekening mee worden gehouden dat het concept van atomaire valentie op dat moment nog niet bekend was, dus het was niet precies bekend waarom sommige stoffen in variabele verhoudingen konden worden gecombineerd en andere niet.
Voorbeeld van de wet van Dalton
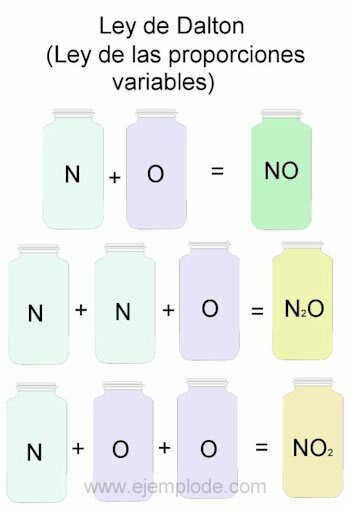
Om de wet van Dalton te illustreren, nemen we als referentie de combinaties van stikstof (N) en zuurstof (O).
Wanneer ze in dezelfde verhouding worden gecombineerd, dat wil zeggen, één voor één, krijgen we stikstofmonoxide:
N + O -> NEE
Als we het stikstofvolume constant houden en de zuurstof met 2 variëren, krijgen we stikstofperoxide:
N + 2O -> NEE2
Als we nu op basis van stikstofmonoxide zuurstof constant houden en de hoeveelheid stikstof met 2 variëren, krijgen we lachgas:
2N + O -> N2OF
Als het artikel nuttig voor u was, vergeet dan niet om ons een +1 te geven.

