Voorbeeld van nomenclatuur van organische verbindingen
Chemie / / July 04, 2021
Organische verbindingen zijn moleculen waarvan het kenmerk is dat ze worden gevormd door een basis van koolstofmoleculen en waterstof, ook bekend als het skelet, en gecombineerd met andere elementen, voornamelijk zuurstof, stikstof en zwavel.
De IUPAC (International Union of Pure and Applied Chemistry, International Union of Pure and Applied Chemistry) heeft algemene regels opgesteld voor de classificatie en nomenclatuur van organische moleculen, waarvan we de belangrijkste uitleggen.
Koolwaterstoffen
Koolwaterstoffen zijn de eenvoudigste organische moleculen, opgebouwd uit een koolstofskelet en waterstofatomen. Er zijn drie soorten koolwaterstoffen:
Alkanen
Ze zijn de eenvoudigste, gevormd door koolstofatomen verbonden door eenvoudige covalente bindingen aan de atomen van waterstof, met de algemene formulering H = 2n + 2, dat wil zeggen, de waterstofatomen zijn tweemaal het aantal waterstofatomen. koolstof, plus 2. De nomenclatuur wordt gevormd met de numerieke voorvoegsels met- voor 1 koolstofatoom, et- voor 2, prop- voor 3 en but- voor 4; vanaf 5 koolstofatomen worden de gebruikelijke voorvoegsels pent-, hex-, hept-, oct-, etc. gebruikt. Aan alle alkanen wordt de uitgang -ano toegevoegd.
Voorbeeld: CH4: methaan; C2H6: ethaan; C4H10: butaan; C6H14: hexaan
alkenen
Ze worden gevormd door een koolstofskelet waarin zich een dubbele binding tussen de koolstofatomen bevindt. De algemene formule is H = 2n, dat wil zeggen, de waterstofatomen zijn tweemaal het aantal koolstofatomen. Net als alkanen gebruiken ze voorvoegsels die hun aantal koolstofatomen aangeven, en in dit geval wordt de uitgang -eno toegevoegd. Bovendien is in moleculen met meer dan drie koolstofatomen de koolstof waar de dubbele binding wordt gevonden, beginnend te tellen vanaf de koolstof die zich het dichtst bij bevindt is.
Voorbeelden: C2H4: etheen; C3H6: propeen; C4H8: buteen, 2-buteen; C6H12: Hexeen, 2-hexeen (dubbele binding aan atoom 2), 3-hexeen (dubbele binding aan atoom 3).
Alkynen
Alkynen bevatten een drievoudige binding aan hun koolstofatomen. De algemene formule is H = 2n-2, wat aangeeft dat het molecuul twee waterstofatomen zal bevatten die kleiner zijn dan tweemaal het aantal koolstofatomen. Aan het voorvoegsel dat het aantal koolstofatomen aangeeft, wordt de uitgang -ino toegevoegd. Zoals in het geval van alkenen, wordt de koolstof met de drievoudige binding genoemd, geteld vanaf het uiterste dat er het dichtst bij ligt.
Voorbeelden: C2H2: ethyn; C3H4: fooi; C4H6: butyn, 2-butyn; C6H12: Hexino, 2-hexeen (drievoudige binding aan atoom 2), 3-hexyn (drievoudige binding aan atoom 3).
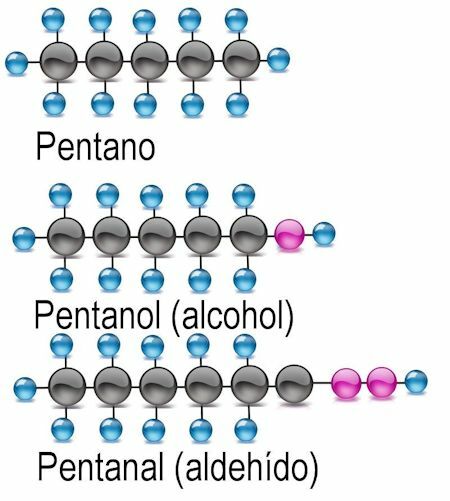
Functionele groepen
Functionele groepen zijn combinaties van atomen die als ion fungeren en een waterstofatoom vervangen in de formule van een alkaan.
radicalen
Het alkaan zonder het waterstofatoom wordt Radicaal genoemd en om het te identificeren wordt de uitgang -ilo toegevoegd:
Voorbeelden CH4: methaan - CH3+ methyl; C2H6: ethaan - C2H5+ ethyl; C4H10: butaan - C4H9+ butyl; C6H14: hexaan - C6H13+ hexyl.
Combinatie van koolwaterstoffen
Een van de gevallen die zich kunnen voordoen, is dat twee of meer koolwaterstoffen in een molecuul worden gecombineerd. De koolwaterstoffen waarmee het wordt gecombineerd, worden boomvormen genoemd. In deze gevallen is de basiskoolwaterstof degene met de langste keten en het koolstofgetal waarbij: de arborescenties worden gevonden, gevolgd door de naam van het radicaal met de uitgang -il, en dan de naam van de koolwaterstof baseren. Het nummer wordt net zo vaak genoemd als de bomen die eraan vast zitten. In het geval dat de arborescenties van hetzelfde radicaal zijn in verschillende koolstofatomen, worden de getallen gescheiden door komma's vermeld, gevolgd door een koppelteken, de naam van het radicaal, dan de nummers van de atomen waaraan het andere radicaal is bevestigd, indien aanwezig, een streepje, de naam van het radicaal en de naam van de koolwaterstof baseren. Als er twee radicalen aan hetzelfde koolstofatoom zijn bevestigd, wordt het aantal twee keer vermeld. Als het verschillende radicalen zijn, wordt het één keer vermeld voor de naam van elk radicaal; als de resten gelijk zijn, wordt het aantal twee keer vermeld. We zullen beginnen met eerst de eenvoudigste boomvormen te noemen (die met de minste hoeveelheid koolstoffen) en vervolgens die met de hoogste hoeveelheid.
Voorbeeld: Een pentaanmolecuul, met twee ethaanradicalen, bevestigd aan koolstof 2 en 3:
2,3-ethylpentaan. Een octaanmolecuul, een propaanradicaal op koolstof 6, methaanradicalen op koolstoffen 4 en 5, en ethaanradicalen, gebonden op koolstoffen 2, 3 en 4: 4,5-methyl-2,3,4-ethyl-6-propyl -octaan.
Alcohol functionele groep
De eenvoudigste van de functionele groepen is alcohol, waarin een waterstofatoom is vervangen door een hydroxylgroep (OH). In deze verbindingen wordt de uitgang -anol toegevoegd aan de naam van de rest. Waar van toepassing moet het koolstofatoom waarin de functionele groep wordt gevonden, worden vermeld:
Voorbeelden CH3OH: methanol: C2H5OH-ethanol; C4H9OH-butanol of 2-butanol; C6H13OH hexanol, 2-hexanol (functionele groep bij atoom 2), 3-hexanol (functionele groep bij atoom 3).
Aldehyde functionele groep
In aldehyden wordt het waterstofatoom uitgewisseld voor de functionele groep -CHO. Om ze te identificeren, wordt de uitgang -anaal toegevoegd en wordt ook het koolstofatoom genoemd waar de functionele groep wordt gevonden:
Voorbeelden CH3COH: methanaal: C2H5Ethanal COH; C4H9COH butanal of 2-butanal; C6H13COH hexanal, 2-hexanal (functionele groep bij atoom 2), 3-hexanal (functionele groep bij atoom 3).
Zure functionele groep
In organische zuren wordt het waterstofatoom uitgewisseld voor de functionele groep -COH. Om ze te identificeren, wordt het woord zuur genoemd en de uitgang -anoic wordt toegevoegd, en het koolstofatoom waar de functionele groep wordt gevonden, wordt ook vermeld:
Voorbeelden CH3COOH: methaanzuur: C2H5COOH ethaanzuur; C4H9COOH-butaanzuur of 2-butaanzuur; C6H13COH hexaanzuur, 2-hexaanzuur (functionele groep bij atoom 2), 3-hexaanzuur (functionele groep bij atoom 3).



