Soorten chemische bindingen
Chemie / / July 04, 2021
Wanneer twee of meer atomen een molecuul vormen, verbinden ze zich met elkaar door middel van a knooppunt tussen elektronen electron van zijn laatste lagen, de meest oppervlakkige. Deze unie heet Chemische binding. Om een chemische binding te vormen, moeten de atomen hun onvolledig octet, dat wil zeggen, minder dan acht elektronen in hun laatste schil, het aantal dat hen chemische stabiliteit zal geven.
Er zijn drie soorten chemische bindingen:
- Ionische bindingen
- Covalente bindingen
- Metalen schakels
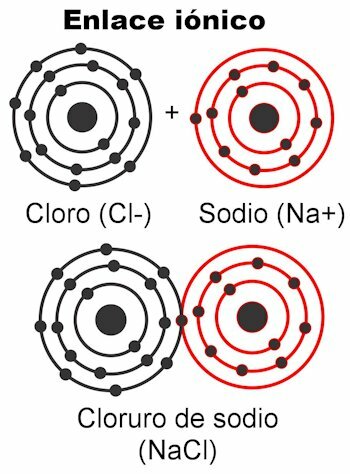
Ionische bindingen
Ionische bindingen zijn die waarin de valentie-elektronen worden aangetrokken door elektrostatische krachten. De atoom(en) die 1 tot 4 valentie-elektronen hebben, kunnen deze afleveren om de binding te vormen; Dit geeft het een positieve lading, omdat het de negatieve ladingen zou wegwerken. Aan de andere kant zullen de atomen met 5 tot 7 valentie-elektronen de nodige kunnen ontvangen om 8 te bereiken.
Hierdoor krijgen ze een negatieve lading, omdat ze elektronen opnemen, die negatief zijn. Het feit dat elektronen kunnen worden opgevangen of afgeleverd
geeft de atomen de elektrische lading. Volgens de wet van Coulomb worden de ladingen gevormd op beide atomen ze gaan elkaar met een kracht aantrekken, dat is de hierboven genoemde elektrostatica. Negatieve ladingen trekken positieve ladingen aan en vice versa. Tegengestelde ladingen trekken aan. Zodra deze kracht ze samenbindt, wordt het molecuul gevormd.Ionische bindingen komen meestal voor tussen metalen en niet-metalen atomen. Metalen geven hun elektronen af en dragen altijd een positieve lading, deelnemend als een kation (+). Niet-metalen zijn elektronenreceptoren en dragen over het algemeen een negatieve lading, nemen deel als anionen (-) maar het komt ook voor dat ze een positieve lading hebben, dit wanneer ze groepen geladen atomen vormen genaamd radicalen, als ammonium NH4+, carbonaat CO3-2, fosfaat PO4-3.
Onder de chemische verbindingen die worden gevormd door ionische bindingen zijn:
- Binaire zouten
- Oxisales
Wanneer deze stoffen worden opgelost in water zij dissociëren, namelijk, scheiden in hun elektrische ladingen en deze worden samen met de waterstofionen H. in het water gedispergeerd+ en hydroxyl (OH-) die water vormen. Het mengsel dat zich vormt is een oplossing genaamd elektrolyt.
- Lees verder: Ionbinding
Covalente bindingen
Covalente bindingen zijn die waarin elektronen worden gedeeld zonder ze los te maken van het atoom, dat wil zeggen, zonder de vorming van elektrische ladingen. De atomen worden bij elkaar gehouden door nabijheid en gebruiken de kracht waarmee de kern elektronen aantrekt. Zodra de binding is gevormd, trekken de twee of meer kernen van de atomen de gedeelde elektronen aan, waardoor de octetregel wordt vervuld en het molecuul stabiel wordt.
Er zijn verschillende vormen van covalente binding, en deze zijn:
- Covalente binding
- Coördinaat covalente binding
- Polaire covalente binding
- Niet-polaire covalente binding
De covalente binding Het is net als degene die in het begin werd beschreven. De deelnemende atomen delen elektronen zodat ze allemaal hun volledige octet hebben. Er zijn hier geen elektrische ladingen, omdat er geen elektronen worden afgestoten, ze worden gewoon gedeeld.
In de covalente binding coördinerenvalent het is slechts één atoom dat alle elektronen bijdraagt die nodig zijn voor de binding. Het andere atoom bindt zich eenvoudig aan elkaar en neemt deze elektronen als zijn eigen. Het molecuul wordt zo gevormd. Dit is bijvoorbeeld het geval voor zwavelzuur H2SW4 waarin zwavel twee elektronenparen deelt met zuurstofatomen.
In de polaire covalente binding, zijn de krachten tussen de atomen naar één kant van het molecuul gekanteld. Dit wanneer er verschillende soorten atomen zijn in het molecuul. Deze kracht wordt gemeten in Debye-eenheden, en hoe hoger de waarde aan één kant van het molecuul, hoe polairder het zal zijn. Dit betekent dat er palen in de constructie worden gevormd en daarom krijgen ze deze naam. Zijn krachten zijn asymmetrisch.
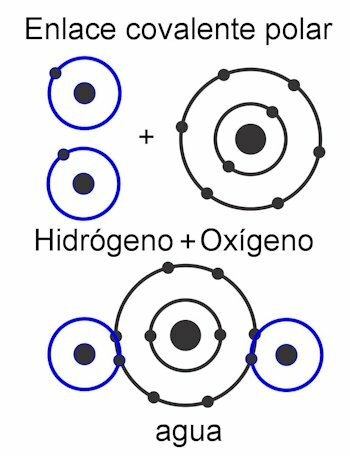
In de niet-polaire covalente binding, de krachten tussen de atomen zijn uniform door het hele molecuul en daarom worden er geen polen gevormd in de structuur. Het werkt als een enkele eenheid en daarom is het erg moeilijk, bijna onmogelijk, om de ladingen te verdelen. Hierdoor is het onoplosbaar in water. Dit is het geval van verbindingen zoals alkanen, die hun gelijke krachten door het molecuul hebben. Zijn krachten zijn symmetrisch.

- Lees verder: Covalente binding
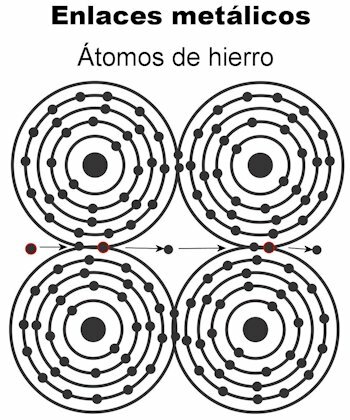
Metaalverbinding
De atomen van een metaal worden bij elkaar gehouden door middel van metaalbindingen. Bij dit type binding worden de elektronen van alle atomen aangetrokken om een kristallijn rooster te vormen dat stevig blijft. De bindingen van het kristalrooster hebben alle elektronen afgewisseld en ingericht om elektrische stroom en warmte te transporteren wanneer het aan hen wordt doorgegeven. In overgangsmetalen is deze structuur van metaalbindingen opmerkelijker, omdat hun atomen groter zijn.
Voorbeelden van ionbinding bond
Sommige stoffen met ionische bindingen zijn:
- NaCl natriumchloride. De ionen zijn Na+ en Cl-.
- Kaliumchloride KCl. De ionen zijn K+ en Cl-.
- Calciumchloride CaCl2. De ionen zijn Ca+2 en Cl-.
- Magnesiumchloride MgCl2. De ionen zijn Mg+2 en Cl-.
- Strontiumchloride SrCl2. De ionen zijn Sr+2 en Cl-.
- Bariumchloride BaCl2. De ionen zijn Ba+2 en Cl-.
- Aluminiumchloride AlCl3. De ionen zijn Al+3 en Cl-.
- Na natriumsulfaat2SW4. De ionen zijn Na+ En dus4-2.
- Kalium K-sulfaat2SW4. De ionen zijn K+ En dus4-2.
- Calciumsulfaat CaSO4. De ionen zijn Ca+2 En dus4-2.
- Calciumsulfaat MgSO4. De ionen zijn Mg+2 En dus4-2.
- Strontiumsulfaat SrSO4. De ionen zijn Sr+2 En dus4-2.
- Bariumsulfaat BaSO4. De ionen zijn Ba+2 En dus4-2.
- Na natriumfosfaat3PO4. De ionen zijn Na+ en PO4-3.
- Kalium K-fosfaat3PO4. De ionen zijn K+ en PO4-3.
- Magnesiumfosfaat Mg3(PO4)2. De ionen zijn Mg+2 en PO4-3.
- Calciumfosfaat Ca3(PO4)2. De ionen zijn Ca+2 en PO4-3.
- Aluminiumfosfaat AlPO4. De ionen zijn Al+3 en PO4-3.
- IJzerfosfaat Fe3(PO4)2. De ionen zijn Fe+2 en PO4-3.
- IJzerfosfaat FePO4. De ionen zijn Fe+3 en PO4-3.
Voorbeelden van covalente binding
Sommige stoffen die covalente bindingen vertonen zijn:
- Methaan CH4.
- ethaan C2H6.
- propaan C3H8.
- Butaan C4H10.
- Pentaan C5H12.
- Hexaan C6H14.
- Heptaan C7H16.
- Octaan C8H18.
- Propyleen CH2= CH2–CH3.
- Acetyleen C2H2.
- Methylalcohol CH3
- Ethylalcohol C2H5
- Propylalcohol C3H7
- Isopropylalcohol CH3CH (OH) CH3.
- 2-propanon of aceton CH3Auto3.
- Formaldehyde HCHO.
- Aceetaldehyde CH3
- Propionaldehyde CH3CH2
- Butyraldehyd CH3CH2CH2
- Mierenzuur HCOOH.
Voorbeelden van metaalbinding
Sommige stoffen die metaalbinding vertonen zijn:
- Zink Zn
- Cadmium Cd
- Koperen Cu
- Zilver Ag
- Goud Au
- Nikkel Ni
- Palladium Pd
- Platina Pt
- Kobalt Co
- Rhodium Rho
- Iridium Go
- ijzer Fe
- Ruthenium Ru
- Osmium Os
- Mangaan Mn
- Chroom Cr
- Molybdeen Mo
- Wolfram W
- Vanadium V
- Zrconium Zr
Volgen met:
- Atomen
- Ion
- metalen
- Geen metalen
- Alkanen
- Oplossingen



