20 Eksempler på kjemiske fenomener
Miscellanea / / July 04, 2021
De kjemiske fenomener (eller kjemiske reaksjoner) er de fenomenene der endringer forekommer i materie, og nye stoffer som kalles "produkter" dannes, og andre som kalles "reaktanter" brytes ned. For eksempel: vedråte, papirbrenning, kompostering.
Kjemiske reaksjoner kan være spontan (reaksjoner som oppstår uten behov for energi eller katalysatorer) eller ikke spontan (reaksjoner som trenger bidrag fra energi, katalysatorer eller noen ekstern intervensjon for å forekomme). Mange ganger, for at en reaksjon skal skje, er det nødvendig at reagensene har en temperatur spesifikk, a pH en innstilt trykkverdi osv.
Det kan også være viktig å kontrollere hastighet som kjemiske reaksjoner oppstår. De katalysatorer De er stoffer som tilsettes en kjemisk reaksjon for å øke hastigheten, mens hemmere er stoffer som reduserer hastigheten på kjemiske reaksjoner. Andre faktorer som påvirker hastigheten på en kjemisk reaksjon er temperatur, trykk, konsentrasjon av reaktanter og selve reaksjonens natur.
Det kan tjene deg:
Typer kjemiske fenomener
Kjemiske reaksjoner kan være:
Uorganiske reaksjoner. Gripe inn uorganiske forbindelser og kan klassifiseres i henhold til:
- Den forstand reaksjonen oppstår i.
-
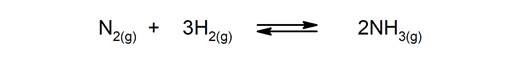
Reversible reaksjoner. De forekommer begge veier, slik at produktene kan brytes ned og danne reaktantene igjen.
-
Irreversible reaksjoner. De skjer bare på en måte.

-
Reversible reaksjoner. De forekommer begge veier, slik at produktene kan brytes ned og danne reaktantene igjen.
- Partikeltypen som reagerer.
-
Syre-base reaksjoner. H ionoverføring skjer+.

-
Oksidasjonsreduksjonsreaksjoner. En av reaktantene oksiderer (øker antallet oksidasjon), mens den andre reduseres (dens oksidasjonstall synker). I disse reaksjonene forekommer elektronoverføring.

-
Syre-base reaksjoner. H ionoverføring skjer+.
- Reaksjonshastigheten.
-
Raske reaksjoner. De oppstår på veldig kort tid.
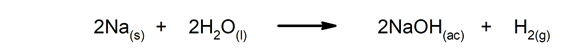
-
Sakte reaksjoner De tar lang tid å fullføre.
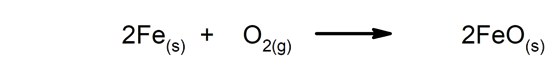
-
Raske reaksjoner. De oppstår på veldig kort tid.
- Formen på energien den avgir eller absorberer.
-
Eksoterme reaksjoner. Når de oppstår, frigjør de varmen.
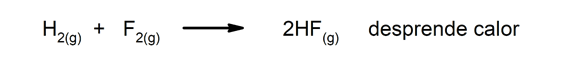
-
Endotermiske reaksjoner. Når de oppstår, absorberer de varme.

-
Eksplosive reaksjoner. Når de oppstår, avgir de lys.

-
Endoluminøse reaksjoner. For å skje trenger de lys.

-
Eksoterme reaksjoner. Når de oppstår, frigjør de varmen.
- Type transformasjon.
-
Syntese eller tilleggsreaksjoner. To stoffer kombineres for å danne et nytt stoff.
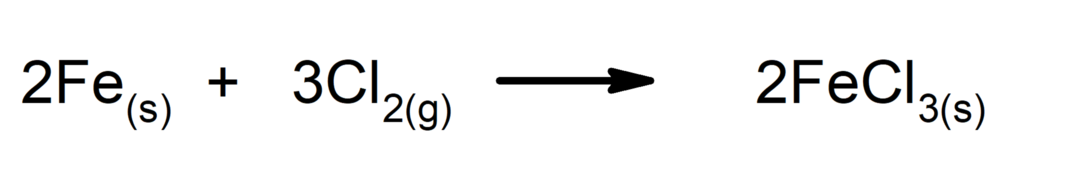
-
Nedbrytningsreaksjoner. Ett eller flere stoffer brytes ned i deres enkleste bestanddeler.
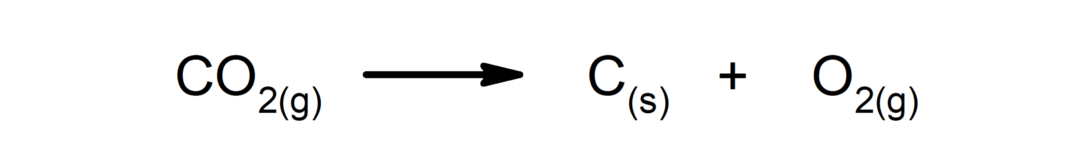
-
Forskyvnings- eller substitusjonsreaksjoner. Ett element eller en forbindelse erstatter et annet i en forbindelse, og frigjør det.
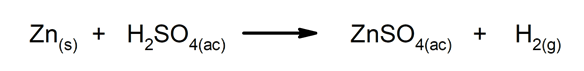
-
Doble substitusjonsreaksjoner. To forbindelser bytter ut elementer eller forbindelser samtidig.

-
Syntese eller tilleggsreaksjoner. To stoffer kombineres for å danne et nytt stoff.
Organiske reaksjoner. De er reaksjoner der organiske forbindelser griper inn. De har mange klassifiseringer basert på typen organisk forbindelse som reagerer og reaksjonstypen den gjennomgår. Noen eksempler er:
-
Halogenering av alkaner. Et hydrogen er erstattet av a alkan av et halogen.
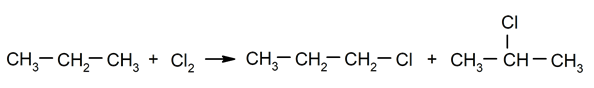
-
Forbrenning av alkaner. En alkan reagerer med oksygen for å generere karbondioksid og vann hvis forbrenningen er fullført.
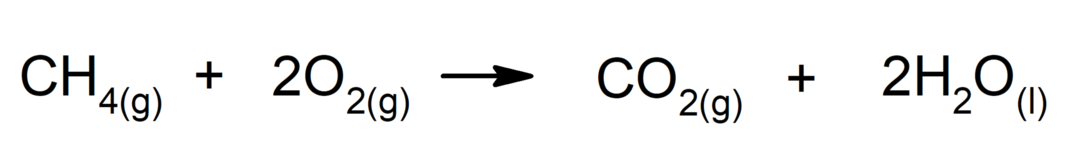
-
Halogenering alkener. Halogener er erstattet av ett eller begge hydrogenene av karbonene som er involvert i dobbeltbindingen.
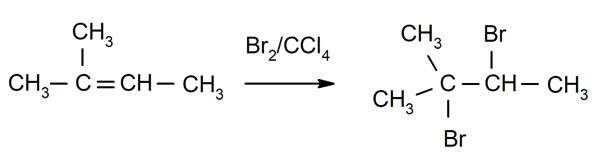
-
Hydrogenering av alkener. Hydrogener tilsettes karbonene som er involvert i dobbeltbindingen for å danne den tilsvarende alkanen.
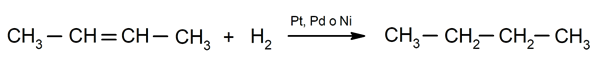
Betydningen av kjemiske fenomener
Mange kjemiske fenomener opprettholde livet av levende ting, som fordøyelse hos mennesker og dyr, fotosyntese i planter og respirasjon i begge.
En annen veldig viktig kjemisk prosess, spesielt i løpet av mikroorganismer, er den gjæring, som vanligvis brukes til fremstilling av mat som oster, yoghurt, vin og øl.
Alle de øke og vekst av en levende skapning Det involverer kjemiske reaksjoner som finner sted i det, noen ganger stimulert av visse miljøforhold.
Eksempler på kjemiske fenomener
Rundt oss er det mange tilfeller av kjemiske fenomener eller prosesser som inkluderer dem:
- Tre råte
- Forbrenning papir
- Motstand mot antibiotika bakterie
- Melk som blir sur
- Desinfisere et sår med alkohol
- Bruk fruktsalt for å bekjempe halsbrann
- Brenner et lys
- Blodpropp
- Muskelutmattelse etter intens trening
- Død av insekter av insektmidler
- Å skaffe roquefortost
- Å skaffe cider
- Å skaffe yoghurt
- Kompostering
- Ensilage
- Å skaffe bioetanol fra melasse
- Hovne blikkbokser
- Råttent egg
- Rusting av et rist
- Å skaffe biodiesel fra palmeolje
Kjemiske fenomener i industrien
Visse kjemiske fenomener er også nøkkelen iindustri. Til å begynne med forbrenningen av hydrokarboner (som bensin, diesel eller parafin) produserer Energi å kjøre maskiner som håndterer utallige industrielle prosesser.
På den annen side, den stålindustri, papir, plast, byggevarer, maling, narkotika, produkter til agro, etc., er basert på ulike kjemiske fenomener som galvanisering, elektrolyse og mange andre mer.
Generasjonen av nye energikilder (som biodiesel og bioetanol) er også basert på denne typen fenomen.
Transformasjonen av energi
I kjemiske fenomener er det vanlig at det er det Energiomgjøring. For eksempel når den kjemiske energien som finnes i bindingene til et bestemt molekyl transformeres til elektrisk energi eller frigjøres som varme (dette skjer i eksoterme fenomener, for eksempel når saltsyre blandes med sink), er det en transformasjon av Energi. Det samme skjer når lysenergi fanges opp og transformeres til kjemisk energi.
Noen kjemiske prosesser krever at varmen løper og kalles "endoterm". Andre krever tilstedeværelse av katalysatorer eller kofaktorer.



