20 eksempler på alkaner
Miscellanea / / July 04, 2021
De alkaner de er en slags hydrokarboner der et variabelt antall karbonatomer er sammenføyd av enkeltbindinger, som et skjelett, og hvert karbonatom er i sin tur knyttet til hydrogenatomer, som til slutt kan erstattes av andre atomer eller funksjonelle grupper. For eksempel: kloroform, metan, oktan.
De molekylær formel av de åpne lineære kjedealkanene er CnH2n + 2hvor C representerer karbon, H representerer hydrogen og n representerer antall karbonatomer. Alkaner er mettede hydrokarboner, noe som betyr at de ikke har dobbelt- eller trippelbindinger. For å navngi dem bruker du suffiks "-Ano" etter å ha navngitt karbonkjeden ved hjelp av prefiks tilsvarer antall karbonatomer (et- (2), pro- (3), men- (4), pen- (5), hex- (6), hep- (7), etc).
Det kan tjene deg:
Klassifisering av alkaner
Innenfor alkanene blir de vanligvis gjenkjent to store grupper: åpen kjede (også kalt acyklisk) og lukket kjede (eller syklisk).
Når forbindelser med åpen kjede De presenterer ingen erstatning av hydrogenene som følger med hvert karbonatom, de kalles lineære alkaner: disse er de enkleste alkanene. Når de presenterer en substitusjon av noen av deres hydrogener med en eller flere karbonkjeder, kalles de forgrenede alkaner. De vanligste substituentene er etylgrupper (CH
3CH2-) og metyl (CH3-).For deres del er det forbindelser med en enkelt syklus i molekylet (monosyklisk) og andre med flere (polysykliske). De sykliske alkaner de kan være homosykliske (de er dannet med eksklusiv intervensjon av karbonatomer) eller heterosykliske (hvor andre atomer deltar, for eksempel oksygen eller svovel).
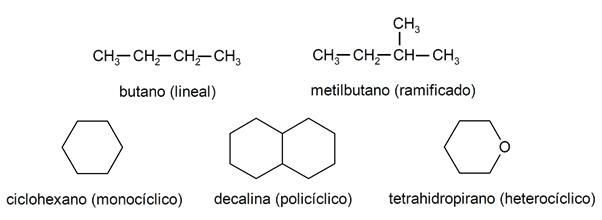
Fysiske egenskaper til alkaner
Generelt, fysiske egenskaper av alkaner er betinget av molekylvekt (i sin tur knyttet til lengden på karbonkjeden). De med lavest antall karbon er gassformig til temperatur miljøet, de som spenner fra 5 til 18 karbonatomer er væsker, og over dette tallet er fast (ligner voks).
Å være mindre tett enn vann, har de en tendens til å flyte på det. Generelt er alkaner uoppløselige i vann og oppløselige i organiske løsningsmidler.
Poenget med kokende og av fusjon av alkaner avhenger av deres molekylær masse, det vil si på lengden på karbonkjeden, selv om de også avhenger mange ganger av atommers romlige arrangement. Lineære og sykliske alkaner har høyere kokepunkter enn forgrenede.
Kjemiske egenskaper til alkaner
Alkaner er preget av å være kjemiske forbindelser av veldig dårlig reaktivitet, derfor er de også kjent som "parafiner" (på latin, parum affinis betyr "lav affinitet"). De er forbindelser som har veldig høy aktiveringsenergi når de er involvert i kjemiske reaksjoner. Den viktigste reaksjonen som alkaner kan gjennomgå er forbrenning genererer, i nærvær av oksygen, varme, karbondioksid og vann.
Alkaner er grunnlaget for et viktig utvalg av reaksjoner assosiert med industrielle prosesser veldig viktig, er det mest tradisjonelle drivstoffet. De fremstår også som sluttprodukter av biologiske prosesser som metanogen gjæring utført av noen mikroorganismer.
Eksempler på alkaner
Noen eksempler på alkaner (inkludert noen kjente lineære og forgrenede) er:
- Kloroform (fancy navn på triklormetan; CHCl3). Damp av dette stoffet pleide å brukes som bedøvelsesmiddel. Den er avviklet for dette formålet fordi den ble funnet å skade organer viktig, for eksempel lever eller nyrer. Bruken i dag er først og fremst som løsningsmiddel eller kjølevæske.
- Metan (CH4). Det er den enkleste alkanen av alle: den består av bare ett karbonatom og fire hydrogenatom. Det er en gass som forekommer naturlig ved spaltning av forskjellige organiske substrater og er hovedkomponenten i naturgass. I nyere tid har det blitt anerkjent som en av gassene som bidrar mest til den såkalte drivhuseffekten.
- Octane (C8H18). Det er åtte-karbon alkanen og er av stor betydning siden det bestemmer den endelige kvaliteten på nafta, som er en blande av forskjellige hydrokarboner. Denne kvaliteten måles ved drivstoffets oktan- eller oktantall, som tar som referanse en lav detonerende (indeks 100) og en høy detonerende (indeks 0).
- Heksan (C6H14). Det er et viktig løsemiddel, og innånding bør unngås, siden det er veldig giftig.
- Butan (C4H10). Sammen med propan (C3H8), utgjør de såkalte flytende petroleumgassene (LPG), som dannes i gassposer under oljeutvinningsprosessen. For øyeblikket blir bytting av bensin eller diesel med LPG som drivstoff fremmet siden det er av et mer miljøvennlig hydrokarbon (det avgir bare karbondioksid og vann under forbrenningen).
- Icosano (C20H42). Det er tjue-karbon alkanen (prefikset 'ico' betyr tjue)
- Syklopropan (C3H6). Tidligere ble det brukt som bedøvelsesmiddel
- n-heptan (C7H16). Det er den som blir tatt som referanse for nullpunktet i bensinoktanskalaen, noe som ville være minst ønskelig, siden den brenner eksplosivt. Det er hentet fra harpiks av visse planter.
- 3-etyl-2,3-dimetylpentan (C9H20)
- 2-metylbutan (C5H12)
- 3-klor-4-n-propylheptan (C10H21Cl)
- 3,4,6-trimetylheptan (C10H22)
- 1-brom-2-fenyletan (C8H9Br)
- 3-etyl-4-metylheksan (C9H18)
- 5-isopropyl-3-metylnonan (C13H28)
- Kubansk (C8H8)
- 1-brompropan (C3H7Br)
- 3-metyl-5-n-propyloktan (C12H26)
- 5-n-butyl-4,7-diethyldekan (C18H28)
- 3,3-dimetyldekan (C12H26)