100 eksempler på kjemiske grunnstoffer
Miscellanea / / November 13, 2021
De kjemiske elementer er en type sak som ved ingen prosedyre eller kjemisk reaksjon de kan reduseres eller dekomponeres til andre enklere elementer. Av denne grunn kan det sies at et element er alt saken laget av atomer av samme og unike klasse, det vil si atomer som har samme atomnummer (likt antall protoner), selv om de har ulik atommasse. For eksempel: svovel, bor, krom, tinn.
Den første definisjonen av et kjemisk grunnstoff ble introdusert av Lavoisier på Traite Élémentaire de Chimie, i 1789. Tilbake på 1700-tallet delte Lavoisier enkle stoffer inn i fire grupper:
Periodisk system for grunnstoffer
I dag kjenner de hverandre 118 kjemiske grunnstoffer. De er alle samlet, klassifisert og organisert i henhold til mange av egenskapene deres i et grafisk skjema kjent som det periodiske system for elementene, som opprinnelig ble skapt av den russiske kjemikeren Dimitri Mendeleyev i 1869. Det periodiske system er sammensatt av 18 grupper (kolonner) og 7 perioder (rader), der de kjemiske elementene er lokalisert.
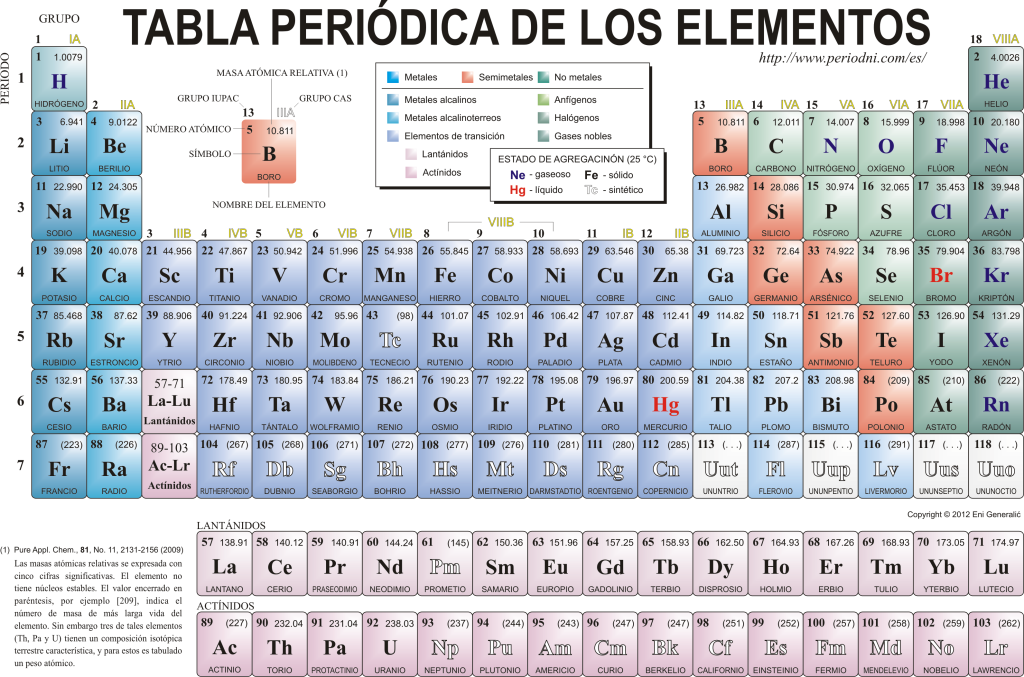
De hovedgrupper som finnes i denne tabellen er:
Alkalimetallene (gruppe 1), jordalkalimetallene (gruppe 2), skandiumfamilien, som inkluderer jordarter og aktinider (gruppe 3), titanfamilien (gruppe 4), vanadiumfamilien (gruppe 5), kromfamilien (gruppe 6), manganfamilien (gruppe 7), jernfamilien (gruppe 8), koboltfamilien (gruppe 7). 9), nikkelfamilien (gruppe 10), kobberfamilien (gruppe 11), sinkfamilien (gruppe 12), jordelementer (gruppe 13), karbonidelementer, i denne gruppen er Karbon, som utgjør grunnlaget for livet på jorden (gruppe 14), nitrogendannende elementer (gruppe 15), amfigenetiske elementer, inkluderer oksygen, et grunnleggende element for de puster av levende vesener (Gruppe 16), halogenelementer (Gruppe 17) og edelgasser (Gruppe 18).
Mange av disse elementene har stabile eller radioaktive isotoper, det vil si at det samme kjemiske elementet, for eksempel hydrogen (H), kan ha flere isotoper (1H, 2H, 3H). Dette betyr at hvert isotopatom har samme antall protoner (som betyr at det tilhører det samme kjemiske elementet) og et annet antall nøytroner.
Noen isotoper er ikke stabile (radioaktive), dvs. gå i oppløsning i en viss tid, sender ut visse partikler (nøytroner, fotoner, alfapartikler, blant andre) og genererer andre stabile eller radioaktive isotoper. Kjemiske grunnstoffer har egenskaper som poenget med kokende og det av fusjon, elektronegativitet, tetthet og ioneradius, blant andre. Disse egenskapene er viktige fordi de lar oss forutsi oppførselen, reaktiviteten osv.
Hvordan presenteres grunnstoffene i det periodiske system?
Hvert kjemisk element er karakterisert i Periodiske tabell ved å bruke en viss symbolikk. For det første, i midten av hver boks dets universelle symbol, som består av en eller to bokstaver (etter konvensjon, hvis det er to bokstaver, skrives den første med store bokstaver og den neste med små bokstaver).
Over og til venstre vises i liten skrifttype su atomnummer, som er den som indikerer mengden protoner som dette elementet har. Under elementsymbolet vises navnet og over, til venstre, vises navnet. atommasse slektning. I tillegg angir fargen som elementsymbolet er representert i dets aggregeringstilstand (i henhold til representasjonen som brukes i hvert periodisk system).
De forskjellige elementene til stede atomradier variabler og, ettersom antallet protoner i kjernen øker, jo større tiltrekning som kjernen utøver på elektronene, så har atomradiusen en tendens til å avta. Når atomradiusen er liten, tiltrekkes elektronene på det ytterste nivået av skyen veldig til kjernen, så de gir seg ikke lett. Det motsatte skjer med grunnstoffer med høye atomradier: de gir lett fra seg sine ytre elektroner.
Dermed øker atomradiusen fra topp til bunn når vi går gjennom gruppene i det periodiske systemet og avtar fra venstre til høyre når vi går gjennom deres perioder.
Eksempler på kjemiske grunnstoffer
| Kjemisk element | Symbol |
| Aktinium | Ac |
| Aluminium | Til |
| Americium | ER |
| Antimon | Sb |
| Argon | Ar |
| Arsenikk | Ess |
| Astat | På |
| Svovel | S |
| Barium | Ba |
| Beryllium | Være |
| Berkelium | Bk |
| Vismut | Bi |
| Bohrio | Bh |
| Bor | B |
| Brom | Br |
| Kadmium | CD |
| Kalsium | AC |
| California | Jfr |
| Karbon | C |
| Cerium | EC |
| Cesium | Cs |
| Klor | Cl |
| Kobolt | Co |
| Kobber | Cu |
| Chrome | Cr |
| Curium | Cm |
| Darmstadio | Ds |
| Dysprosium | Dy |
| Dubnium | Db |
| Einsteinium | Det er |
| Erbium | Er |
| Scandium | Sc |
| Tinn | Sn |
| Strontium | MR |
| Europium | Eu |
| Fermium | Fm |
| Fluor | F |
| Kamp | P |
| Francius | Fr |
| Gadolinium | Gd |
| Gallium | Ga |
| Germanium | Ge |
| Hafnium | Hf |
| Hassio | Hs |
| Helium | jeg har |
| Hydrogen | H |
| Jern | Tro |
| Holmium | Ho |
| indisk | I |
| Jod | Jeg |
| Iridium | Å gå |
| Ytterbium | Yb |
| Yttrium | OG |
| Krypton | Kr |
| Lantan | De |
| Lawrencio | Lr |
| Litium | Li |
| Lutetium | man |
| Magnesium | Mg |
| Mangan | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| Merkur | Hg |
| Molybden | Mo |
| Neodym | Na |
| Neon | Ne |
| Neptunium | Np |
| Niob | NB |
| Nikkel | Ingen |
| Nitrogen | N |
| Nobelio | Nei |
| Gull | Au |
| Osmium | Du |
| Oksygen | ELLER |
| Palladium | P.S |
| Sølv | Ag |
| Platina | Pt |
| Lede | Pb |
| Plutonium | Pu |
| Polonium | Po |
| Kalium | K |
| Praseodym | Pr |
| Love | P.m |
| Protactinium | Pa |
| Radio | Ra |
| Radon | Rn |
| Rhenium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| Ruthenium | Ru |
| Rutherfordio | Rf |
| Samarium | Ja |
| Seaborgio | Sg |
| Selen | Jeg vet |
| Silisium | Ja |
| Natrium | Na |
| Tallium | Tl |
| Tantal | Ta |
| Teknetium | Tc |
| Tellur | Te |
| Terbium | Tb |
| Titanium | Du |
| Thorium | Th |
| Thulium | Tm |
| Kopernikus | Cn |
| Livermorio | Lv |
| Røntgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Unntrium | Uut |
| Uran | ELLER |
| Vanadium | V |
| Wolfram | W |
| Xenon | Xe |
| Sink | Zn |
| Zirkonium | Zr |

Følg med:
