30 Eksempler på binært salg
Eksempler / / November 09, 2023
De binære salter (nøytrale salter) dannes når et metall og et ikke-metall kombineres. Are kjemiske forbindelser består av bare to kjemiske elementer. For eksempel: natriumklorid (NaCl) og kaliumbromid (KBr).
- Se også: Metaller og ikke-metaller
Eksempler på binære salter
- Natriumklorid (NaCl)
- Jern(II)klorid (FeCl2)
- Jern(III)klorid (FeCl3)
- Kobolt(II)sulfid (CoS)
- Kobolt(III)sulfid (Co2Ja3)
- Bly(II)sulfid (PbS)
- Bly(IV)sulfid (PbS2)
- Kalsiumklorid (CaCl2)
- Natriumfluorid (NaF)
- Litiumklorid (LiCl)
- Strontiumklorid (SrCl2)
- Bariumklorid (BaCl2)
- Aluminiumklorid (AlCl3)
- Magnesiumsulfid (MgS)
- Rubidiumklorid (RbCl)
- Kalsiumbromid (CaBr2)
- Kaliumsulfid (K2S)
- Magnesiumbromid (MgBr2)
- Sinksulfid (Zn2S)
- Litiumbromid (LiBr)
- Nikkelklorid (NiCl2)
- Uran(III)klorid (UCl3)
- Sølvbromid (AgBr)
- Sølvjodid (AgI)
- Kaliumbromid (KBr)
Nomenklatur for binære salter
I følge tradisjonell nomenklatur navngis binære salter ved å skrive navnet på det ikke-metalliske elementet med endelsen -ide. På den annen side er navnet på det metalliske elementet skrevet i henhold til dets oksidasjonstilstand:
- For den laveste oksidasjonstilstanden skrives det med endelsen -oso. For eksempel: jernholdig klorid (FeCl2), hvor jern har en oksidasjonstilstand på 2+.
- For den høyeste oksidasjonstilstanden skrives det med endelsen -ico. For eksempel: jernklorid (FeCl3), hvor jern har en oksidasjonstilstand på 3+.
I følge Systematic Nomenclature navngis binære salter ved å skrive navnet på det ikke-metalliske elementet med et prefiks som indikerer mengden av atomer av dette elementet i forbindelsen. I tillegg er endelsen -uro plassert i navnet på det ikke-metalliske elementet. Deretter plasseres navnet på det metalliske elementet. For eksempel: magnesiumdiklorid (MgCl2) og jerntriklorid (FeCl3).
I følge Stocks nomenklatur navngis binære salter ved å skrive navnet på det ikke-metalliske elementet med endelsen -ide. Deretter plasseres navnet på det metalliske elementet etterfulgt av dets oksidasjonstilstand skrevet i romertall og i parentes. For eksempel: jern(II)klorid (FeCl2) og kobolt(III)sulfid (Co2Ja3).
Anvendelser av binære salter
- De brukes som kjølemedier i næringsmiddel- og farmasøytisk industri. For eksempel: kalsiumklorid (CaCl2).
- De brukes til å behandle metalloverflater mot korrosjon. For eksempel: natriumfluorid (NaF).
- De brukes til å regulere fuktighet i papir- og byggebransjen. For eksempel: kalsiumklorid (CaCl2).
- De brukes i glassindustrien for å fjerne urenheter. For eksempel: silisiumtetraklorid (SiCl4).
- De brukes som matlagingsingredienser. For eksempel: natriumklorid (NaCl).
Fysiske egenskaper til binære salter
- De har høye smeltepunkter fordi de består av ioniske bindinger.
- De leder elektrisk strøm når de er oppløst eller smeltet.
- De vanligste saltene har lav hardhet.
- De er ikke komprimerbare.
- De fleste kan løses opp i vann.
Hvordan oppnås binære salter?
Binære salter kan oppnås gjennom noen av følgende kjemiske reaksjoner:
Reaksjon mellom et metall og et ikke-metall. For eksempel: reaksjonen mellom natrium (Na) og diklorid (Cl2) produserer natriumklorid (NaCl).
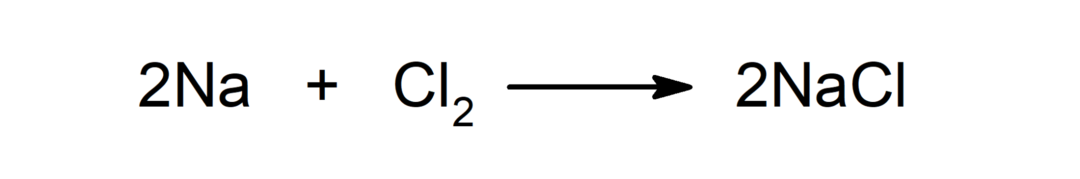
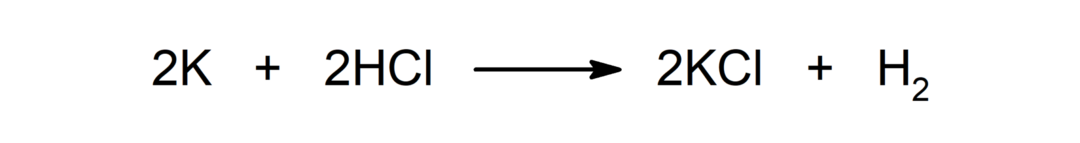
Reaksjon mellom et metall og en syre. For eksempel: Reaksjonen mellom kalium (K) og saltsyre (HCl) produserer kaliumklorid (KCl) og dihydrogen (H)2).
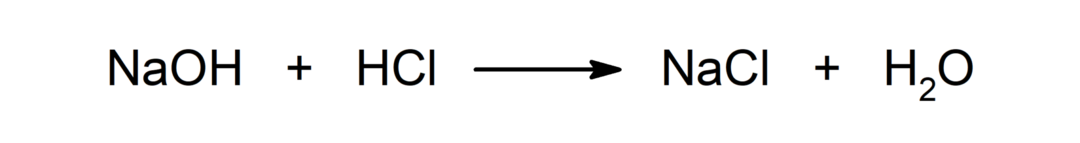
Reaksjon mellom en syre og en base. For eksempel: Reaksjonen mellom saltsyre (HCl) og natriumhydroksid (NaOH) produserer natriumklorid (NaCl) og vann (H)2ENTEN).
Følg med:
- oksysalter
- nøytrale salter
- sure salter
Referanser
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juárez, E. (2020). Nomenklaturvideo 1: binære salter og kjemisk reaksjon.
- Acurio Arias, M. V., & Delgado Méndez, M. OG. (2022). Spillbasert læringsveiledning for "binære forbindelser" i videregående kjemi ved utdanningsenheten "Herlinda Toral" (Bacheloroppgave, National University of Education).
- Cabrera, M. J. H. (2005). Studie fra første prinsipper for elektroniske og strukturelle egenskaper til binære og ternære forbindelser (Doktorgradsavhandling, University of La Laguna).



