Hva er elektrolyse
Kjemi / / July 04, 2021
I kjemi, Elektrolyse er fenomenet der en elektrisk strøm går gjennom en vandig løsning av en ionisk forbindelse, og starter rett ionene (ladede partikler) av forbindelse a to elektroder, positiv (Anode, tiltrekker seg negativt ladede anioner) og negative (Katode, tiltrekker seg positivt ladede kationer). Dette fenomenet styres av loven om elektrostatikk, som indikerer at motsatte ladninger tiltrekker hverandre.
Elektrolytter
I 1883, Michael Faraday oppdaget at vandige løsninger av visse stoffer leder elektrisk strøm, mens løsninger av andre stoffer ikke gjør det.
For å teste om en vandig løsning leder elektrisk strøm eller ikke, designet Faraday et enkelt apparat bestående av en 110 volt DC-krets, en lampe, Y to metall- eller grafittelektroder koblet til til gjeldende kilde.
Hvis elektrodene er nedsenket i vann, er strømmen så liten at lampen ikke lyser. det samme gjelder hvis de dyppes i en sukkeroppløsning.
Tvert imot, hvis de er nedsenket i en løsning av Natriumklorid NaCl eller fra Saltsyre HC
l, lampen skinner sterkt, noe som beviser at oppløsning er en utmerket dirigent. På den annen side bruker du eddiksyre CH3Konsentrert COOH leder løsningen strømmen dårlig, men når syren blir fortynnet med vann H2Eller, den elektriske ledningsevnen øker.Under strømmen gjennom forskjellige løsninger oppnås forskjellige produkter ved elektrodene.
I løpet av studiene på elektrolyse utledet Faraday følgende lover:
1. lov: Mengden stoff som har sin kjemiske transformasjon i en elektrode er proporsjonal med mengden elektrisitet som går gjennom løsningen.
2. lov: Hvis samme mengde elektrisitet ledes gjennom forskjellige løsninger, er stoffets vekt dekomponert eller avsatt på de forskjellige elektrodene er proporsjonal med ekvivalente vekter av nevnte stoffer.
For å nevne et eksempel:
Det antas at du har fem forskjellige elektrolytiske celler. Den første med Saltsyre HC1, den andre med Kobbersulfat CuSO4, den tredje med Antimonious Chloride SbCl3, den fjerde med Tannklorid SnCl2 og den femte med Stannic Chloride SnCl4.
Den samme strømmen føres gjennom en serie elektrolytiske celler, til det er frigjort 1008 gram hydrogen (a Tilsvarende vekt av hydrogen) av saltsyreoppløsningen, vektene (i gram) av de andre produktene som frigjøres samtidig De er:
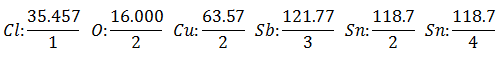
De Tilsvarende vekt har verdien av Atomic Weight of the Element delt på Valencia of the Element.
For å frigjøre en tilsvarende vekt for en hvilken som helst vare, trenger du 96500 Coulombs. Denne mengden strøm kalles 1 Faraday.
Faraday-enheten
Ampere er definert som en jevn strøm som avleier 0,001118 gram sølv (Ag) fra en løsning av sølvnitrat (AgNO3) om et sekund. Siden atomvekten til sølv er 107,88 g / mol, forholdet 107,88 / 0,001118 gir antall ampere-sekunder eller Coulombs strøm kreves å deponere en kjemisk ekvivalent av sølv. Denne mengden er 96494 Coulombs (96500-verdien er grov for enklere beregninger), og kalles 1 Faraday of Electricity.
Elektroder
Faraday ringte Anode til positiv elektrode, og katode til negativ elektrode. Han opprettet også begrepene Anion og Kation, brukt på stoffene som vises henholdsvis ved anoden og ved katoden under elektrolyse.
Foreløpig er en annen definisjon for elektroder:
Anode: Elektrode der det er tap av elektroner eller oksidasjon.
Katode: Elektrode der det er elektronforsterkning eller reduksjon.
Elektrolytter og ikke-elektrolytter
Ledningen av elektrisk strøm gjennom løsninger ble ikke forklart tilfredsstillende før i 1887, da Svante Arrhenius gjorde sin teori kjent. Før vi satte pris på og forstå Arrhenius-teorien, redegjorde vi først for noen av fakta som var kjent for vitenskapen da Arrhenius formulerte den:
De Ikke-elektrolyttløsninger de har eiendommer som kan beregnes ved å anvende Raoults lov. Damptrykket og de observerte kokepunktene og frysepunktene til disse løsningene er praktisk talt de samme som de beregnede verdiene.
De Raoults lov forklarer at damptrykket til hver løsemiddel i løsning avhenger av sin egen molfraksjon i den, multiplisert med damptrykket i ren tilstand.

Raoults lov mislykkes når den brukes på elektrolyttløsninger i vann. Variasjonene av damptrykk og av kokepunktene og frysepunktene er alltid større enn de som er forutsagt av ovennevnte lov, og videre øker de ved fortynning.
Slike avvik er representert av verdien i, som er forholdet mellom variasjonen observert i frysepunktet mellom variasjonen beregnet i frysepunktet:

Verdien av i er et mål på avviket fra Raoults lov, og er lik 1 når det ikke er noe avvik.
Elektrisk ledningsevne til elektrolytter
Arrhenius undersøkte ledningsevnen til vandige elektrolyttløsninger for å finne ut hvordan ledningsevnen varierte med elektrolyttkonsentrasjonen.
Den målte molar konduktivitet (som er konduktiviteten som tilsvarer ett mol oppløst elektrolytt; det vil si den spesifikke ledningsevnen som er referert til ett mol, og fant at den økte med fortynning.
Arrhenius sammenlignet resultatene med målinger av avvik fra Raoults lov, og fant et nært forhold mellom disse og molær ledningsevne. I hans teori forklares oppførselen til elektrolytter:
“Elektrolyttmolekyler dissosieres i elektrisk ladede partikler som kalles ioner. Oppløsningen er ufullstendig, og det er en likevekt mellom molekylene og deres ioner. Ionene leder strømmen når de beveger seg i løsningen ”.
Avvik fra Raoults lov skyldes økningen i antall partikler som følge av delvis dissosiasjon av molekylene.
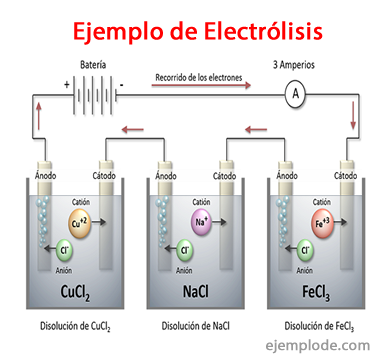
Eksempler på elektrolyse
Noen løsninger som oppfører seg som elektrolytter, det vil si at de har kapasitet til elektrolyse er:
Natriumklorid NaCl
Saltsyre HC1
Natriumsulfat Na2SW4
Svovelsyre H2SW4
Natriumhydroksyd NaOH
Ammoniumhydroksid NH4Åh
Natriumkarbonat Na2CO3
Natriumbikarbonat NaHCO3
Salpetersyre HNO3
Sølvnitrat AgNO3
Sinksulfat ZnSO4

