Organisk kjemi Eksempel
Kjemi / / July 04, 2021
De Organisk kjemi Det er den delen av generell kjemi som har ansvaret for studien og den funksjonelle klassifiseringen av kjemiske forbindelser hvis strukturelle element er Karbon, til stede i overflod i levende materie; Dette skaper et veldig differensiert univers av uorganisk kjemi, dedikert til kjemiske forbindelser klassifisert som mineraler.
Karbonatomet har fire elektroner i det siste skallet av sin elektroniske konfigurasjon. Denne egenskapen, sammen med atomerradien, gjør at den kan kobles sammen med kovalente bindinger til andre atomer av samme element, i mange kjeder, og danner et stort mangfold av kjemiske forbindelser stabil.
Du kan sjekke Kovalente bindinger.
Slike kjemiske forbindelser, i tillegg til karbonatomer som gir dem sin opprinnelige struktur, inneholder hydrogenatomer som hovedkomplementet for karbonvalensen. I tillegg, i dette mangfoldet av forbindelser, er det de med intervensjon av oksygenatomer, Nitrogen, halogener, svovel og til og med fosfor, jordalkaliske og jordalkaliske elementer og metaller av overgang. Avhengig av hvem som er involvert i molekylet, vil det være de fysiske og kjemiske egenskapene til det endelige stoffet.
De organiske forbindelser er til stede i hele levende materie; fremme og opprettholde alle biologiske funksjoner, i motsetning til uorganiske eller mineralstoffer, som har blitt brukt av mennesker til kommersielle formål, for eksperimentering eller for å oppfylle visse innenlandske oppgaver.
Historie av organisk kjemi
Før 1828 ble det allerede skilt mellom organisk kjemi og uorganisk kjemi. Organisk materiale var assosiert med en skapelse gjennom en "vital force", og til det uorganiske med det ikke-levende, med mineralet. Gitt disse forestillingene kunne man ikke forvente å få organiske forbindelser fra uorganiske materialer i laboratoriet.
Derimot, i 1828 Friedrich Wöhler (1800-1882) lyktes i å fremstille en organisk substans, Urea CO (NH2)2, et viktig produkt av animalsk metabolisme, fra uorganiske forbindelser. Behandling Lead Cyanate Pb (CNO)2 med Ammoniakk NH3 å få Ammoniumcyanat NH4CNO; Denne forbindelsen ble faktisk dannet, men da løsningen ble kokt for å krystallisere ammoniumcyanatet, ble den transformert til urea.
Denne kjemiske endringen er et eksempel på Intern omgruppering, hvor antallet eller klassen av atomer i molekylet ikke endres, men bare deres rekkefølge innenfor det. Disse typer transformasjoner er veldig vanlige i organisk kjemi.
Wöhlers oppdagelse initierte oppgivelsen av livskraftsteorien senere fullstendig forkastet ved å bli fulgt av fremstilling av mange andre organiske forbindelser i laboratorium. Til tross for dette eksisterer kvalifiseringene av uorganisk og organisk, siden uorganiske forbindelser er relatert til mineralprodukter og organiske forbindelser, som faktisk er forbindelser av karbon og hydrogen og deres derivater, er av typen produsert av levende organismer.
Selv om lovene for generell kjemi gjelder like for begge forbindelser, begrunner forskjellige årsaker og gjør denne inndelingen nødvendig. Dermed er organiske og uorganiske forbindelser forskjellige i forskjellige egenskaper, slik som: deres Løselighet foretrukket i organiske løsningsmidler (eter, alkohol, kloroform, etc.) og i henholdsvis vann Stabilitet (organiske forbindelser spaltes ved relativt lave temperaturer), og Reaksjonens art; for uorganiske forbindelser er de ioniske, enkle og praktisk talt øyeblikkelige, og for organiske forbindelser er de kovalente, komplekse og sakte.
Organiske forbindelser
Karbonforbindelser med kjeder på opptil nitti atomer er kjent. De kjeder Karbonatomer kan være lineær og forgrenet og har enkle kovalente bindinger eller har dobbelt- eller trippelbindinger. Det er kjent at mer enn 2500 forbindelser inneholder bare karbon og hydrogen (Hydrokarboner).
Isomerisme av organiske forbindelser
I uorganiske forbindelser representerer en formel generelt en enkelt forbindelse; således er det bare ett stoff med formel H2SW4. Svovelsyremolekylet inneholder to hydrogenatomer, et av svovel og fire av oksygen, i et spesifikt og unikt arrangement. I organiske forbindelser er det sjelden at dette skjer. Således er det for eksempel to forbindelser som reagerer på formelen C2H6Eller etylalkohol eller etanol og dimetyleter.

Jo mer kompleks molekylet, det vil si jo større antall karbonatomer, jo større antall mulige isomerer.
Organisk sammensatt analyse
Analysen av en organisk forbindelse omfatter kvalitativ analyse, den kvantitativ analyse og Funksjonell analyse. I tilfelle man antar at forbindelsen er i uren tilstand, er den tidligere renset av Krystallisering, Destillasjon, Sublimering, Utdrag, etc. Renhetskriteriet kan vurderes ut fra dets fysiske konstanter, som smeltepunkt, kokepunkt, tetthet, løselighet, krystallinsk form, brytningsindeks, etc.
De kvalitativ analyse Det bekreftes ved å undersøke tilstedeværelsen av elementene som utgjør forbindelsen, spesielt karbon, hydrogen og nitrogen, og noen ganger halogener, svovel og fosfor.
De kvantitativ analyse Det utføres ved å bruke metodene som brukes til kvalitativ analyse. Utgangspunktet er en viss mengde stoff som gjennomgår forbrenning, og karbondioksidet samles opp og veies. karbon og vanndamp dannet for å beregne prosentandelen karbon og hydrogen i forbindelse. Resultatene av den kvantitative analysen letter beregningen av empirisk formel, selv om molekylformelen bare kan bli funnet etter bestemmelsen av stoffets molekylvekt. Men problemet er ikke løst ennå, fordi den samme molekylformelen kan tilsvare forskjellige isomerer.
Klassifisering av organiske forbindelser
I henhold til deres struktur er organiske forbindelser delt inn i forbindelser alifatisk, aromatisk Y heterosyklisk. Alifatiske forbindelser er relatert til metan CH4, er åpne kjeder, bortsett fra cykloparaffiner, og skylder navnet sitt på at animalsk og vegetabilsk fett tilhører denne gruppen.
De aromatiske forbindelser, lukket kjede, nært knyttet til benzen, C6H6, og de skylder navnet sitt det faktum at mange av dem har duftende, behagelige lukter.
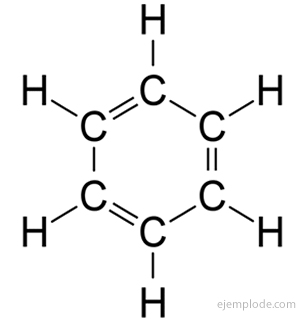
Benzenring
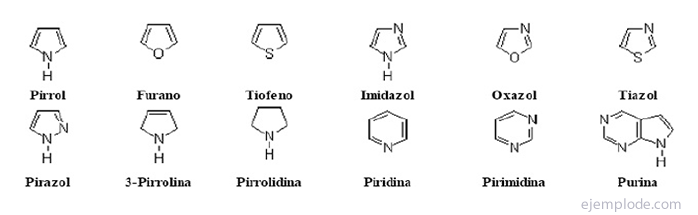
De heterosykliske forbindelser De er lukkede forbindelser der det er et annet grunnstoff enn karbon i ringen.
Etter deres konstitusjon er de:
Hydrokarboner, som igjen, på grunn av typen lenker den har, er klassifisert som Alkanes, Alkenes Y Alkynes. I tillegg er sykloalkaner, benzen og deres derivater som bare består av karbon og hydrogen i denne kategorien.
Heterosykliske forbindelser
Halogenerte derivater:R-X
Nitroforbindelser:R-NO2
Sulfonsyrer:R-SO3H
Nitriler (ELLER alkylcyanider) og Isonitriler:R-CN og R-NC. De er forskjellige i hvordan nitrogenatomet er bundet i molekylet.
Alkoholer:R-OH
Fenoler: Forbindelser basert på en ryggrad som består av en benzenring med en tilsatt hydroksylgruppe.

Ethers:R-O-R
Mercaptans: R-SH
Thioethers:R-S-R
Tiosyrer:R-COSH
Aldehyder:R-CHO
Ketoner:R-CO-R
Karboksylsyrer:R-COOH
Du går ut:R-COOM (M for metall)
Estere: R-COO-R
Anhydrider: R-CO-O-OC-R
Aminer:R-NH2, R-NH-R, 2R-N-R
Aldosa karbohydrat:-CHOH-CHOH-CHO
Ketose-type karbohydrater:-CHOH-CO-CH2Åh
Organometalliske forbindelser:R-M-R
Metallalkylhalogenider:R-MX (også kjent som Grignard Reagents)

