Eksempel på kjemiske baser
Kjemi / / July 04, 2021
I generell kjemi, Baser er en kategori av kjemikalier som oppfyller flere funksjoner:
-Reager med syrer i en nøytralisering, produserer salt og vann.
-Reguler hydrogenpotensial, pH, hever verdien, hvis de helles i midten der en reaksjon blir funnet.
-Løp så Kjemiske reagenser for et stort antall reaksjoner.
Basene kan være forskjellige arter, begge Uorganisk kjemi pr Organisk kjemi, Som Hydroksider, den Amines og Alkoholer, for eksempel.
For å definere oppførselen til basene brukes de tre viktigste syrebaseteoriene: Arrhenius, Brönsted-Lowry og Lewis.
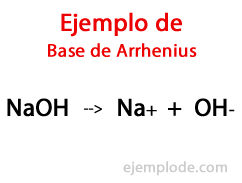
Basene ifølge Arrhenius
I følge den svenske kjemikeren Svante Arrhenius, Basene er de kjemiske stoffene som gi hydroksylioner (OH-) til et reaksjonsmedium, spesielt hvis det er en vandig løsning. Således vil det med de tilgjengelige hydroksylionene være et Alkalisk pH, det vil si med en verdi større enn 7 og opptil 14 avhengig av hvor mye Base som er tilstede på måletidspunktet.
Dette er en av de enkleste og mest praktiske teoriene å anvende, siden det ikke har komplikasjoner for å skille stoffene som deltar i reaksjonen. Det er velkjent hvilke som er syren og hvilke som er basen.
Innenfor denne teorien er det ubestridelig uorganiske hydroksider, slik som natriumhydroksid (NaOH) og kaliumhydroksid (KOH).
Basene ifølge Brönsted-Lowry
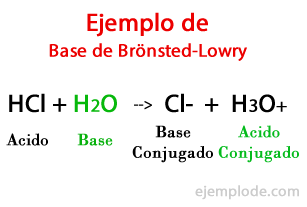
I følge teorien formulert av den danske Johannes Brönsted og britene Thomas Martin Lowry, en base er en kjemisk art i stand til å motta protonene som en annen, syren, skal gi under en kjemisk reaksjon. Protonen er generelt relatert til den positive ladningen som kjennetegner den, slik at vi kan knytte den igjen til hydrogenioner (H +).
Når utvekslingen skjer i den kjemiske reaksjonen, produktene heter: "Conjugated Acid Base", og "Conjugated Base Acid", basert på reaktantene som dannet dem.
For denne teorien, Ammoniakk (NH3) er den mest representative saken. For Brönsted og Lowry er stoffene som er i stand til å beholde hydrogenioner (H +) baser. I dette tilfellet vil ammoniakk, ved å oppføre seg som en base, skaffe seg et hydrogen i sin struktur og konsolidere seg som et ammoniumion (NH4+), med den overskytende positive ladningen av hydrogen. Ammonium er den konjugerte syre av ammoniakk.
Aminer, organiske forbindelser avledet fra ammoniakk (NH3), slik som metylamin (CH3NH2) når de er i løsning oppfører de seg som baser, og er i stand til å motta positive ladninger i sin struktur, enten fra hydrogen eller karbokering.
En karbokasjon er et organisk ion dannet som en hydrokarbonkjede, som i fravær av et negativt ion, som Det kan være hydroksyl (OH-) eller et halogen (Cl-, Br-), det har en tendens til å binde seg til et sted som kan motta det, som vil være Utgangspunkt.
Basene ifølge Lewis
Den amerikanske forskeren Gilbert Lewis påpekte i sin syrebaseteori at basene er de stoffene som er i stand til å bidra med parene sine gratis elektroner for at en annen skal fullføre sin oktett.
Denne syre-base teorien er et supplement til å bekrefte gyldigheten av sin Octet-regel, der den beskriver hvordan atomer oppnår stabilitet ved å nå et antall på åtte elektroner i sitt siste skall, ved å bruke Bond Kovalent
Hydroksylionet er et godt eksempel på en Lewis-base. Den har et par frie elektroner som et hydrogenion som ikke har elektroner kan nå. Det vil dannes et vannmolekyl. Dermed blir oktetten for molekylets oksygen dannet, og hydrogenene, som er mindre atomer, vil ha sitt par elektroner som vil gjøre dem stabile.

Bruk av viktige baser
De Natriumhydroksyd NaOH Det brukes vanligvis i vandig løsning for å rengjøre stivnet fett i husholdningsovner og industrielle ovner, og oppløse det effektivt. Det brukes også i konsentrert løsning når uforutsette utslipp av et surt stoff oppstår for å nøytralisere det.
De Magnesiumhydroksid Mg (OH)2 Den brukes i en løsning kalt "Milk of Magnesia", for å løse halsbrann, nøytralisere den. Den selges på apotek.
De Kaliumhydroksid KOH Det brukes som et reagens for forsæbningsprosesser, og omdanner fett til såpe.
De Ammoniakk NH3 Det brukes i gassform som et industrielt kjølemiddel, spesielt i isprodusenter. Det er veldig farlig å bruke, siden å puste en konsentrasjon på 5 milligram per liter av det i luften kan være dødelig.
Eksempler på kjemiske baser
Vann H2ELLER
Ammoniakk NH3
Natriumhydroksyd NaOH
Kaliumhydroksid KOH
Magnesiumhydroksid Mg (OH)2
Kalsiumhydroksyd Ca (OH)2
Aluminiumhydroksyd Al (OH)3
Ammoniumhydroksid NH4Åh
Jernholdig hydroksid Fe (OH)2
Jernhydroksyd Fe (OH)3
Hydroksylion (OH-)
Kloridion (Cl-)
Bromidion (Br-)
