Eksempel på kjemiske elementer
Kjemi / / July 04, 2021
Et kjemisk element det er et rent stoff som består av atomer av samme type, i sin tur dannet av et antall protoner og nøytroner i kjernen, og en mengde på elektroner i deres orbitaler. Noen finnes naturlig, andre ved å danne molekylene til en forbindelse, og andre er blitt opprettet gjennom utførelse av laboratorieprosedyrer. Alle kjemiske elementer utgjør saken i hele universet, og opprettholder menneskekroppens eksistens og funksjon.
Hvert element har egenskaper og atferd som skiller det og gjør det unikt, men samtidig presenterer den likheter med en gruppe elementer i manifestasjonen de har i univers. Av denne grunn er det det periodiske systemet for kjemiske elementer, som adresserer disse likhetene for å gruppere elementene sammen og gjøre det lettere å studere deres egenskaper.
Atomnummer av et element
Atomet bærer i kjernen et antall protoner, ledsaget av samme antall nøytroner. Til dette nummeret Det kalles atomnummeret, representert som Z for akademiske formål og i litteratur. For hvert element vil dette tallet være unikt. Det er ikke to elementer med samme atomnummer. Periodisk tabell fokuserer også på dette kriteriet for å bestille dem.
Symbol for et element
I alkymitiden, som strekker seg omtrent fra år 400 til 1000 e.Kr. C. registrerte alkymistene sine eksperimenter med tildeling av symboler til elementene. De var enkle symboler, laget med geometriske figurer, for å representere det enkelte element og transformasjonene som ble studert.
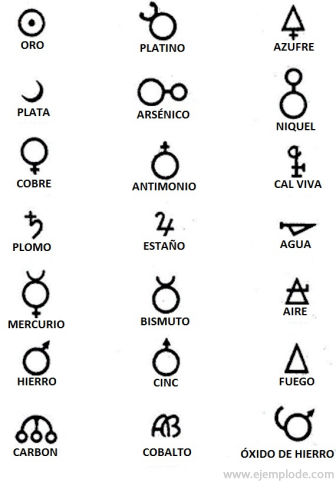
Noen eksempler på alkymiske symboler, med navnet på elementet eller forbindelsen de representerte.
I epoken for moderne kjemi er elementene fremdeles representert med symboler, i dette tilfellet bokstaver som refererer til navnet deres på latin eller engelsk.
For eksempel:
Symbolet for Sodium er Na, med sitt latinske navn Natrium
Symbolet på gull er Au, med sitt latinske navn Aurum
Symbolet for Silver er Ag, med sitt latinske navn Argentum
Symbolet for kobber er Cu, med sitt latinske navn Cuprum
Antimonets symbol er Sb, med sitt latinske navn Stibium
Symbolet på Iron er Tro, med sitt latinske navn Ferrum
Symbolet for Merkur er Hg, med sitt latinske navn Hydrargyrum, som betyr "flytende sølv"
Symbolet for Kalium er K, med sitt latinske navn Kalium
Kjemiske elementgrupper:
Periodisk tabell over kjemiske elementer klassifiserer disse etter grupper: gruppe A og gruppe B. Gruppene A er åtte, som inneholder elementene Alkalisk, den Alkaline-Earthy, den Terreos, tre familier av Elements, hvis hode definerer navnet på familien: Carbon familie, Nitrogenfamilien, Svovelfamilien, den Halogener og Edelgasser. Gruppe B består av alle Overgangsmetaller og de sjeldne jordene, som også er to store familier: Lanthanides Y Actinides.
Gruppe IA: Alkaliske elementer:
Serien av alkaliske elementer består av hydrogen (H), litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) og Francium (Fr). De har alle en elektronisk konfigurasjon slik at de i det siste skallet har et elektron. Navnet deres skyldes at når de kommer i kontakt med vann, reagerer de og danner alkalier eller hydroksider. Det er en generell oppførsel mellom disse elementene. Jo større elementet er, desto mer reaktivt er det, siden kraften som kjernen holder på elektronet fra det siste skallet, har mindre og mindre rekkevidde. De er i stand til å danne ioniske bindinger med halogener. For eksempel: Den ioniske bindingen som har rikelig tilstedeværelse, er den av natrium-klor, som danner natriumklorid NaCl.
Gruppe IIA: Alkaliske jordelementer:
Disse elementene er: Beryllium (Be), Magnesium (Mg), Kalsium (Ca), Strontium (Sr), Barium (Ba) og Radium (Ra). De er ikke frie i naturen; på den annen side eksisterer karbonatene og silikatene i relativt overflod. De er argentinske hvite og krystallinske. De kombineres lett med oksygen hvis de utsettes for luft. Dette skyldes delvis at de har to elektroner i sitt siste skall, som er enige i reseptorkapasiteten til oksygen. Barium er gruppens mest aktive element, og sammen med kalsium er de de som har mest industrielle applikasjoner i gruppen.
Gruppe IIIA: Jordelementer:
Gruppe IIIA består av elementene Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) og Thallium (Tl). Bor er et ikke-metallisk element, aluminium er amfotert (amfiprotisk), det vil si at det er i stand til å fungere som en syre og som en base; og de tre andre er metalliske elementer. De har tre elektroner i sitt siste skall, og genererer en valens på +3, selv om Gallium noen ganger virker med en +1 og +2 valens i noen av forbindelsene. Bor er det eneste elementet i denne serien som danner Hydrides. Bor og aluminium danner karbider.
Gruppe IVA: Karbonfamilie:
De representative elementene i gruppe IVA er karbon (C), silisium (Si), Germanium (Ge), tinn (Sn) og bly (Pb). De to første er i utgangspunktet ikke-metalliske i sine egenskaper, men Germanium, Tinn og Bly er metalliske, og jo mer jo høyere er atomnummeret deres. Med unntak av silisium har hvert element valensene +4 og +2.
Karbon og silisium danner forbindelser der atomer av elementene er forbundet med par av delte elektroner. Karbon er essensen av organiske forbindelser ved å assosiere med atomer av hydrogen, oksygen, nitrogen, svovel og noen ganger silisium.
Silisium og Germanium brukes til produksjon av elektroniske komponenter, da de har egenskapen til å oppføre seg som halvledere.
Gruppe VA: Nitrogenfamilie:
Gruppe VA består av elementene Nitrogen (N), Fosfor (P), Arsen (As), Antimon (Sb) og Bismuth (Bi). Nitrogen og fosfor er ikke-metalliske, arsen og antimon er metalloider, og vismut er et metall. Disse elementene kjennetegnes ved å danne hydrider, hvorav den minst giftige er ammoniakk NH3. Nitrogen danner salpetersyre HNO3, involvert sammen med saltsyre i Agua Regia, en blanding som er i stand til å oppløse edle metaller som gull og sølv.
Nitrogen er også involvert i to store grupper av organiske forbindelser kalt aminer og amider, som kan betraktes som derivater av ammoniakk NH.3, ved å erstatte et hydrogen med en hydrokarbonkjede.
Gruppe VIA: Oksygenfamilie:
Bestående av elementene Oksygen (O), Svovel (S), Selen (Se), Tellur (Te) og Polonium (Po). Oksygen er den mest aktive, og har evnen til lett å danne kovalente bindinger. I kontakt med metaller i miljøer med høy luftfuktighet danner det oksider. Det danner et resonansmolekyl som heter Ozon, som beskytter planeten mot UV-stråling.
Gruppe VIIA: Halogener:
Navnet betyr "Salgsformere". Gruppen består av grunnstoffene Fluor (F), Klor (Cl), Brom (Br), Jod (I) og Astate (At). De har syv elektroner i det siste skallet, noe som gjør at de kan være reseptorer for ett elektron. Denne kvaliteten gjør at de knytter seg til elementene i gruppe IA og danner binære salter. Fluor kjennetegnes ved å ha den største elektronegativiteten av hele det periodiske systemet, med en verdi på 4,0, hvor motstykket er Cesium, med elektronegativitet på 0,7. Denne egenskapen gjør at den har styrke til å tiltrekke seg andre atomer og prioritere å danne et bånd med de.
Gruppe VIIIA: Edle gasser:
Også kalt Inert Gas Group, består den av elementene Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) og Radon (Ra). De er elementene som har all sin komplette elektroniske konfigurasjon, så de er ikke i stand til å reagere under vanlige forhold. De brukes hovedsakelig til lysende kommersielle skilt, og avgir synlig lys når en elektrisk strøm rammer dem.
Gruppe B: Overgangsmetaller:
I ti grupper på tre elementer hver grupperes overgangsmetallene. Disse inkluderer de beste elektriske lederne: Sølv (Ag), Kobber (Cu), Gull (Au); de beste strukturelle komponentene for bybygging og prosjektering; Jern (Fe), Titan (Ti), Aluminium (Al), Zirkonium (Zr), Wolfram (W); de beste katalysatorkomponentene: Nikkel (Ni), Vanadium (V), Platina (Pt); og de viktigste belegningsingrediensene: Kadmium (Cd), Krom (Cr), sink (Zn). De håndterer vanligvis valenser mellom +1 og +3, men elementer som Chromium håndterer valensene +2, +3, +6.
Sjeldne jordarter: Lanthanides og Actinides:
De kalles sjeldne jordarter på grunn av knapphet på planeten. De består av to grupper: Lanthanides og Actinides. De finnes på de to separate linjene i det periodiske systemet. De arbeider generelt med en valens på +3, og har en tendens til å danne hydroksider. Det viktigste elementet blant dem er Cerium, som brukes til fremstilling av pyroforiske legeringer (Alloy Mischmetal, for steiner til lightere), i gasslanger for belysning og til fremstilling av spesielle briller som absorberer ultrafiolette stråler og varmestråling.
De kraftigste radioaktive elementene, som uran (U) og plutonium (Pu), er en del av disse gruppene. som gitt deres ustabilitet, frigjør energi og går i oppløsning, og mister alfapartikler (kjerner av Helium). Senere blir de mindre ustabile elementer, ifølge den radioaktive serien.


