10 przykładów mieszanek gazowych
Różne / / July 04, 2021
Mieszaniny substancje gazowe Są to jedne z najłatwiejszych do osiągnięcia, ponieważ bardzo możliwe jest zmieszanie substancji znajdujących się w tym stanie skupienia. Na przykład: Mieszanka neonów, argonu i ksenonu, insektycyd w aerozolu, powietrze i hel.
Praktycznie wszystkie gazy można łączyć bez ograniczeń, oczywiście uwarunkowane niektórymi chemiczne, fizyczne i zasadniczo związane z aspektami bezpieczeństwa użytkownika, które: manipuluje. Podobnie jak różne rodzaje mieszanin, które są ustalane między substancjami, mieszaniny gazy mają również właściwości, które są dla nich unikalne.
Nauka o gazowane mieszanki jest zwykle tak samo użyteczna jak gazy w stanie czystym: ta sama wiedza o powietrzu, która jest obecna w atmosfera byłaby niemożliwa, gdyby nie wiedza o proporcjach i zachowaniu mieszanych gazów.
W ten sposób konieczne jest poznanie niektórych funkcje mieszanin gazowych, takich jak właściwość ciśnienia cząstkowego (wywieranego przez każdy z gazów w ciągu mieszaniny) i frakcji molowej (stosunek liczby moli składnika gazowego do liczby moli całej mieszaniny Soda). Mole wyrażają ilość gazu w mieszaninie.
Prawo Daltona stwierdza, że całkowite ciśnienie mieszaniny gazów jest równe sumie ciśnień cząstkowych każdej z nich jeden z poszczególnych gazów, które w nim uczestniczą (jest to uzależnione od tego, że gazy nie reagują między Tak). Ciśnienie cząstkowe rozumiane jest tutaj jako takie, jakie wywierałby każdy z gazów, gdyby znajdował się tylko w tym samym pojemniku i w tych samych warunkach temperatura. A) Tak:
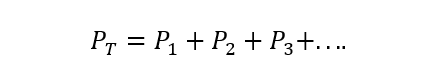
Gdzie PT to całkowite ciśnienie i P1, P2 I p3 są ciśnieniami cząstkowymi hipotetycznych gazów 1, 2 i 3 w mieszaninie gazów.
Korzystając z prawa Daltona, opracowano wyrażenie do obliczenia Ciśnienie cząstkowe gazu w mieszaninie gazowej, jeśli znamy jego całkowite ciśnienie i jego ułamek molowy.
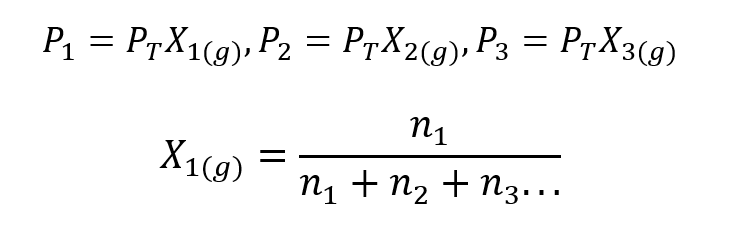
Gdzie X1, X2 Tak X3 są ułamkami molowymi hipotetycznych gazów 1, 2 i 3 w mieszaninie gazów, oraz nie1, nie2 Tak nie3 to ilości substancji każdego z tych gazów w tej samej mieszaninie.
Jeden z główne właściwości składników w mieszaninach to stężenie, które można wyrazić w różnych jednostkach. W przypadku mieszanin gazowych stężenie jej składników można wyrazić w ppm (części na milion), jednostce odnoszącej się do jego objętości. Oznacza to, że pewna ilość ppm składnika w mieszaninie gazów jest stosunkiem objętości tej pewnej ilości do objętości każdego miliona jednostek mieszaniny.
Ważne jest, aby to zauważyć ppm gazu zależą od temperatury i ciśnienia gazu. Z tego powodu do obliczenia ppm gazu zwykle stosuje się normalne warunki ciśnienia i temperatury. (CNPT), które dają normalny stan do temperatury 0 stopni Celsjusza i 1013 hektopaskali (1 bar) Nacisk. Jeśli te warunki nie są używane, musisz określić, które z nich będą używane.
Może Ci służyć:
Przykłady mieszanek gazowych
Poniższa lista zawiera mieszaniny gazów z wyszczególnieniem pierwiastków występujących w mieszaninie:
- Powietrze (mieszanina 21% tlenu i 79% azotu oraz inne gazy w niewielkich proporcjach)
- Cronigón (mieszanina 99% argonu i 1% tlenu)
- Trimix (mieszanina tlenu, azotu i helu)
- Mieszanka neonów, argonu i ksenonu
- Mieszanka 85% metanu, 9% etanu, 4% propanu i 2% butanu.
- Sześciofluorek siarki i powietrze
- Środek owadobójczy w aerozolu
- Powietrze i hel
- Nitrox (mieszanina powietrza wzbogacona w tlen i azot)
Postępuj zgodnie z: