20 przykładów alkanów
Różne / / July 04, 2021
alkany są rodzajem węglowodory w którym zmienna liczba atomów węgla jest połączona ze sobą pojedynczymi wiązaniami, jak szkielet, i każdy atom węgla jest z kolei przyłączony do atomów wodoru, które ostatecznie mogą zostać zastąpione innymi atomy lub grupy funkcyjne. Na przykład: chloroform, metan, oktan.
formuła molekularna alkanów o otwartym łańcuchu liniowym wynosi CnH2n + 2, gdzie C oznacza węgiel, H oznacza wodór, a n oznacza liczbę atomów węgla. Alkany są węglowodorami nasyconymi, co oznacza, że nie zawierają podwójnych ani potrójnych wiązań. Aby je nazwać, użyj przyrostek "-Ano" po nazwaniu łańcucha węglowego za pomocą prefiks odpowiadające liczbie atomów węgla (et-(2), pro-(3), but-(4), pen-(5), hex-(6), hep-(7) itd.).
Może Ci służyć:
Klasyfikacja alkanów
Wśród alkanów są zwykle rozpoznawane dwie duże grupy: łańcuch otwarty (zwany także acyklicznym) i łańcuch zamknięty (lub cykliczny).
Kiedy związki o otwartym łańcuchu Nie wykazują żadnej substytucji wodorów towarzyszących każdemu atomowi węgla, nazywane są alkanami liniowymi: są to najprostsze alkany. Kiedy wykazują podstawienie któregokolwiek ze swoich wodorów przez jeden lub więcej łańcuchów węglowych, nazywane są rozgałęzionymi alkanami. Najczęstszymi podstawnikami są grupy etylowe (CH
3CH2-) i metyl (CH3-).Ze swojej strony istnieją związki z jednym cyklem w cząsteczce (monocykliczne) i inne z kilkoma (policykliczne). cykliczne alkany mogą być homocykliczne (powstają z wyłączną ingerencją atomów węgla) lub heterocykliczne (w których uczestniczą inne atomy, np. tlen lub siarka).
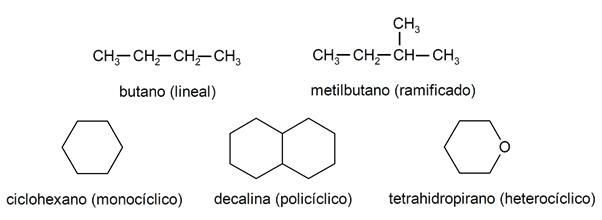
Właściwości fizyczne alkanów
Ogólnie, właściwości fizyczne alkanów warunkuje masa cząsteczkowa (z kolei związana z długością łańcucha węglowego). Ci z najmniejszą liczbą węgli to gazowy do temperatura środowisko, te mające od 5 do 18 atomów węgla są płyny, a powyżej tej liczby są solidny (podobny do wosku).
Będąc mniej gęstą niż woda, mają tendencję do unoszenia się na niej. Na ogół alkany są nierozpuszczalne w wodzie i rozpuszczalne w rozpuszczalnikach organicznych.
Punkt wrzenie i połączenie alkanów zależy od ich masa cząsteczkowa, to znaczy od długości łańcucha węglowego, chociaż zależą one również wielokrotnie od przestrzennego rozmieszczenia atomów. Alkany liniowe i cykliczne mają wyższą temperaturę wrzenia niż alkany rozgałęzione.
Właściwości chemiczne alkanów
Alkany charakteryzują się tym, że związki chemiczne bardzo słaba reaktywność, dlatego nazywa się je również „parafinami” (po łacinie, parum affinis oznacza „niskie powinowactwo”). Są to związki, które mają bardzo wysoką energię aktywacji, gdy są zaangażowane w reakcje chemiczne. Najważniejszą reakcją, której mogą podlegać alkany, jest spalanie generowanie w obecności tlenu, ciepła, dwutlenku węgla i wody.
Alkany są podstawą wielu różnych reakcji związanych z procesy przemysłowe bardzo ważne, będąc najbardziej tradycyjnymi paliwami. Pojawiają się również jako końcowe produkty procesów biologicznych, takich jak fermentacja metanogenna przeprowadzana przez niektórych mikroorganizmy.
Przykłady alkanów
Niektóre przykłady alkanów (w tym niektóre dobrze znane liniowe i rozgałęzione) to:
- Chloroform (wymyślna nazwa trichlorometan; CHCl3). Opary tej substancji były używane jako środki znieczulające. Został przerwany w tym celu, ponieważ stwierdzono jego uszkodzenie organy ważne, takie jak wątroba lub nerki. Obecnie jest stosowany głównie jako rozpuszczalnik lub chłodziwo.
- Metan (CH4). Jest to najprostszy alkan ze wszystkich: składa się tylko z jednego atomu węgla i czterech atomów wodoru. Jest to gaz występujący naturalnie w wyniku rozkładu różnych substratów organicznych i jest głównym składnikiem gazu ziemnego. W ostatnim czasie został uznany za jeden z gazów najbardziej przyczyniających się do tzw. efektu cieplarnianego.
- Oktan (DO8H18). Jest to alkan ośmiowęglowy i ma ogromne znaczenie, ponieważ decyduje o końcowej jakości benzyny ciężkiej, która jest mieszać różnych węglowodorów. Jakość ta jest mierzona liczbą oktanową lub oktanową paliwa, dla której za odniesienie przyjmuje się paliwo o niskiej detonacji (indeks 100) i o wysokiej detonacji (indeks 0).
- Heksan (DO6H14). Jest ważnym rozpuszczalnikiem, należy unikać jego wdychania, ponieważ jest bardzo toksyczny.
- Butan (DO4H10). Wraz z propanem (C3H8), stanowią tzw. gazy płynne (LPG), które powstają w workach gazowych podczas procesu wydobycia ropy naftowej. Obecnie promuje się zastępowanie benzyny lub oleju napędowego LPG jako paliwa, ponieważ jest to bardziej przyjaznego dla środowiska węglowodoru (podczas spalania emituje tylko dwutlenek węgla i wodę).
- Icosano (DO20H42). Jest to alkan dwudziestowęglowy (przedrostek „ico” oznacza dwadzieścia)
- Cyklopropan (DO3H6). Dawniej był używany jako środek znieczulający
- n-heptan (DO7H16). To ten, który jest traktowany jako punkt odniesienia dla punktu zerowego w skali oktanowej benzyny, co byłoby najmniej pożądane, ponieważ spala się wybuchowo. Pozyskiwany jest z żywicy niektórych rośliny.
- 3-etylo-2,3-dimetylopentan (DO9H20)
- 2-metylobutan (DO5H12)
- 3-chloro-4-n-propyloheptan (DO10H21Cl)
- 3,4,6-trimetyloheptan (DO10H22)
- 1-bromo-2-fenyloetan (DO8H9Br)
- 3-etylo-4-metyloheksan (DO9H18)
- 5-izopropylo-3-metylononan (DO13H28)
- kubański (DO8H8)
- 1-bromopropan (DO3H7Br)
- 3-metylo-5-n-propyloktan (DO12H26)
- 5-n-butylo-4,7-dietylodekan (DO18H28)
- 3,3-dimetylodekan (DO12H26)