Pojęcie w definicji ABC
Różne / / April 22, 2022
definicja koncepcji
Azeotropy to mieszaniny związków chemicznych o określonym składzie, które wrze w określonych temperaturach. Podstawową cechą jest to, że mieszanina zachowuje się tak, jakby była pojedynczą czystą substancją, zachowując swoje właściwości i zapewniając łatwość obsługi.

Inżynier chemiczny
Mieszanka może składać się z dwóch lub więcej składników i jej kompozycja jest taki sam zarówno w fazie ciekłej, jak iw fazie gazowej, co generuje podobieństwa z czystymi substancjami. Z tego łatwo wywnioskować, że tej mieszaniny nie można rozdzielić na jej składniki w procesach takich jak: destylacje frakcyjne, ponieważ, jak wspomniano powyżej, zachowa swoje proporcje, zachowując się jak pojedynczy składnik.
Inną cechą charakterystyczną jest to, że temperatura wrzenia tej mieszaniny może być wyższa, niższa lub nawet równa temperaturze jednego z jej składników. Kiedy azeotrop wrze w a temperatura maksymalnego wrzenia, jest znany jako maksymalny azeotrop, a kiedy robi to w najniższej możliwej temperaturze, jest znany jako minimalny azeotrop. Oznacza to, że minimalny azeotrop ma niższą temperaturę wrzenia niż jego czyste składniki i odwrotnie z maksymalnym azeotropem. Np. w mieszaninie metanol - benzen azeotrop jest minimalny (0,61 benzen - 0,39 metanol we frakcjach molowy) o temperaturze wrzenia 58 °C, w zbiorniku, w którym temperatura wrzenia benzenu wynosi 80 °C, a metanolu 65°C
Minimalne i maksymalne azeotropy
Teraz… skąd pochodzi azeotrop? Kiedy występuje odchylenie od Prawo Raoulta, czyli prężność pary mieszaniny azeotropowej nie jest bezpośrednio związana z jej frakcją molową, to właśnie wtedy powstaje pojęcie mieszaniny azeotropowej. Odchylenia te występują, gdy składniki znacznie się przyciągają lub odpychają, to znaczy siły międzycząsteczkowe są bardzo różne w różnych związkach.
Gdy odchylenie jest dodatnie, mamy azeotrop minimalny, natomiast jeśli odchylenie jest ujemne, azeotrop maksymalny. Aby lepiej zrozumieć tę koncepcję, spójrzmy na niektóre grafiki:
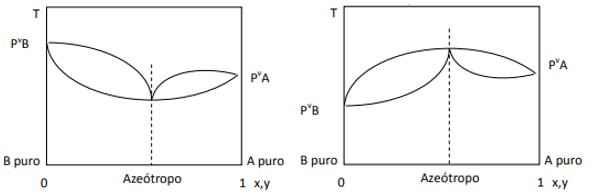
Tutaj obserwujemy, że gdyby mieszanina była idealna, zgodnie z prawem Raoulta, prężności par czystych składników powinny być połączone linią prostą, ponieważ cóż, istnieje odstępstwo od tego prawa, które powoduje powstawanie minimalnych i maksymalnych azeotropów, w zależności od tego, czy istnieje większe czy mniejsze powinowactwo między składniki. Gdy odchylenie od prawa Raoulta jest ujemne, jak na rysunku po lewej, jest to minimum przy diagram ciśnienia, ale maksimum na wykresie temperatury (stąd azeotrop maksimum). Z drugiej strony, jeśli odchylenie jest dodatnie w stosunku do prawa Raoulta, będzie to maksimum w ciśnieniu vs. skład, ale minimum na wykresie temperatura vs. skład (tutaj mamy minimalny azeotrop). Nie myl wykresów ciśnienie vs. skład i temperatura vs. kompozycja.
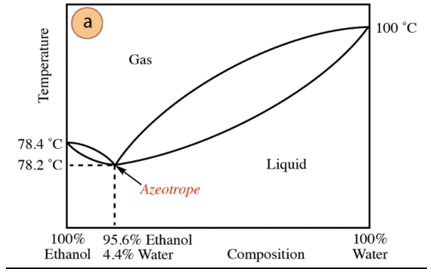
W przypadku mieszaniny etanol-woda występuje minimalny azeotrop o składzie 95,6% etanolu i 4,4% wody. Temperatura wrzenia mieszaniny azeotropowej jest o 78,2°C niższa niż w przypadku czystych składników. Załóżmy więc, że destyluje się mieszaninę wody z etanolem o wysokiej zawartości wody (bliskiej 100%). Nie będzie możliwe uzyskanie czystego alkoholu, ponieważ na każdym etapie destylacji będą uzyskiwane większe frakcje. etanolu, ale nigdy nie osiągając 100%, stopniowo zbliża się do składu mieszaniny azeotropowej (najniższy punkt pod). Dlatego podobnie jak woda ma tendencję do tworzenia minimalnych azeotropów z związki organiczne (ze względu na rodzaj oddziałujących sił międzycząsteczkowych) konieczne jest wcześniejsze usunięcie wody z mieszaniny w celu uzyskania czystego związku. Lub, po uzyskaniu azeotropu, metody ekstrakcja dodatkowej wody.
W związku z powyższym nie jest przypadkiem znalezienie alkoholu (w supermarkecie i Apteka) na poziomie 95%, jest najtańszym produktem, jaki można uzyskać. Aby uzyskać czysty alkohol, konieczne jest „przełamanie” azeotropu za pomocą technika dodatkowe, takie jak zastosowanie środków suszących lub destylacji azeotropowych. Destylacja azeotropowa polega na dodaniu do mieszaniny dodatkowego składnika, który działa poprzez porywanie i interakcja z dowolnym składnikiem mieszaniny (o wyższym powinowactwie) można z niej usunąć.
Tematy w azeotropach
