50 przykładów aldehydów i ketonów
Przykłady / / November 06, 2023
The aldehydy Czy związki organiczne które mają w swojej strukturze karbonylową grupę funkcyjną (= C = O), która jest połączona z łańcuchem węglowym i atomem wodoru. Na przykład: metanal (zwany także formaldehydem), etanal (zwany także aldehydem octowym) i propanal (zwany także propaldehydem).
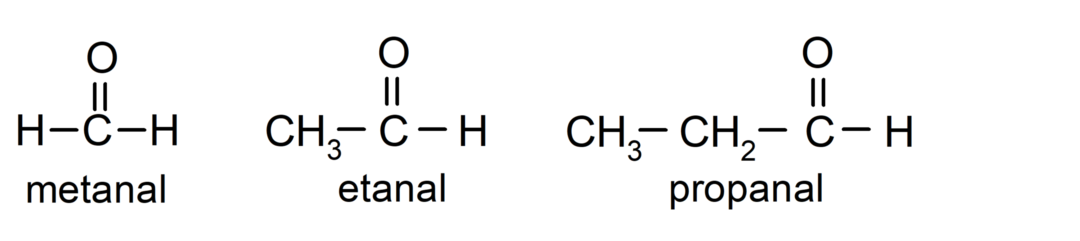
The ketony Są to związki organiczne, które mają w swojej strukturze grupę karbonylową połączoną z dwoma atomami węgla. Na przykład: propanon (zwany także acetonem), butanon i 2-pentanon.
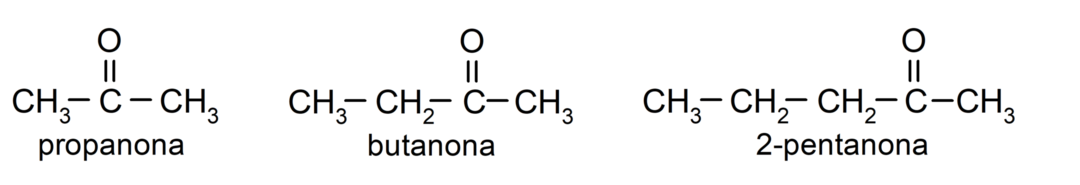
Różnice między aldehydami i ketonami
Główne różnice między aldehydami i ketonami to:
- Aldehydy mają w swojej strukturze karbonylową grupę funkcyjną umieszczoną na jednym końcu, podczas gdy ketony mają grupę karbonylową zlokalizowaną w pozycjach niekońcowych Struktura.
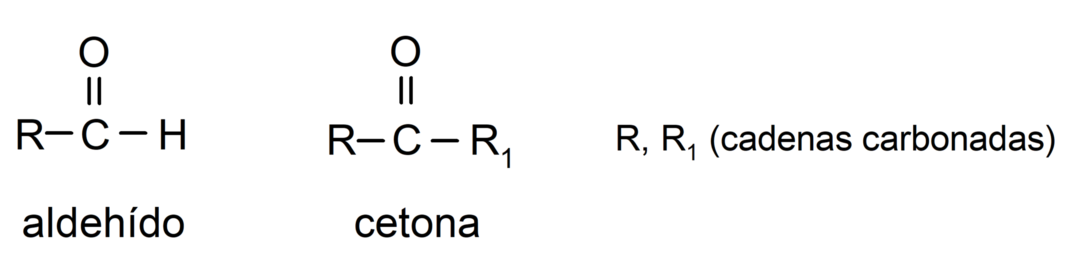
- Aldehydy utleniają się w reakcji z odczynnikiem Tollensa, tworząc metaliczne srebro. Utleniają się również w stosunku do odczynnika Benedykta, tworząc tlenek miedziawy. Ketony nie są utleniane przez żaden z odczynników.
- Aldehydy ulegają redukcji do alkoholi pierwszorzędowych, natomiast ketony do alkoholi drugorzędowych.
Właściwości fizyczne
Właściwości fizyczne aldehydów
Właściwości fizyczne aldehydów są bardzo zróżnicowane, ponieważ zależą od budowy łańcucha węglowego połączonego z grupą karbonylową.
Niektóre są:
- Aldehydy, które są najlepiej rozpuszczalne w wodzie, to te o mniejszych rozmiarach, takie jak metan i etanal.
- Lotne aldehydy mają ostry, a nawet drażniący zapach.
- Grupa karbonylowa nadaje im polarność.
- Zwykle mają wyższą temperaturę wrzenia niż związki chemiczne o podobnej wielkości cząsteczkowej.
Właściwości fizyczne ketonów
Właściwości fizyczne ketonów zależą od tego, jak powstaje łańcuch węglowy połączony z grupą karbonylową.
- Wiele ketonów ma przyjemny zapach.
- Jego rozpuszczalność w wodzie zależy od wielkości łańcucha węglowego przyłączonego do grupy karbonylowej. Im mniejszy łańcuch węglowy, tym lepiej rozpuszczalny będzie keton w wodzie.
- Grupa karbonylowa nadaje im wyraźną polarność.
- Mają dość wysokie temperatury wrzenia w porównaniu ze związkami chemicznymi o porównywalnej wielkości cząsteczkowej.
Właściwości chemiczne
Właściwości chemiczne aldehydów
Wśród właściwości chemicznych aldehydów możemy znaleźć:
Utleniają się, tworząc odpowiedni kwas karboksylowy, to znaczy powstały kwas będzie miał taką samą liczbę atomów węgla w łańcuchu węglowym jak aldehyd to spowodowało. Na przykład:
- Utlenianie odczynnikiem Tollensa (kompleks srebra amonowego w roztworze zasadowym, [Ag (NH3)2]+) z etanalu wytwarza kwas etanowy i metaliczne srebro.
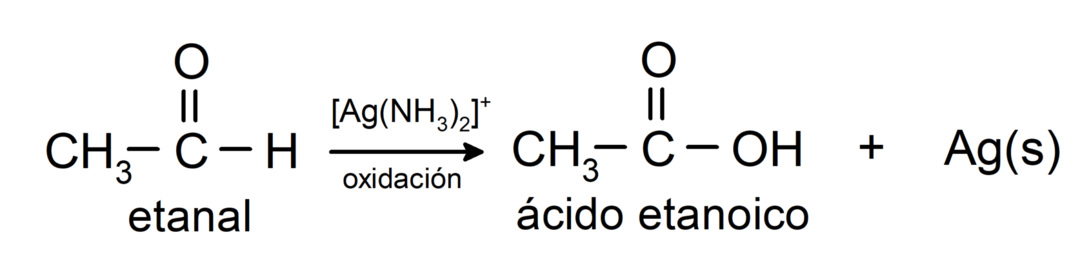
- Utlenianie odczynnikiem Benedicta (alkalicznym roztworem siarczanu miedzi) etanalu daje kwas etanowy i tlenek miedziawy.
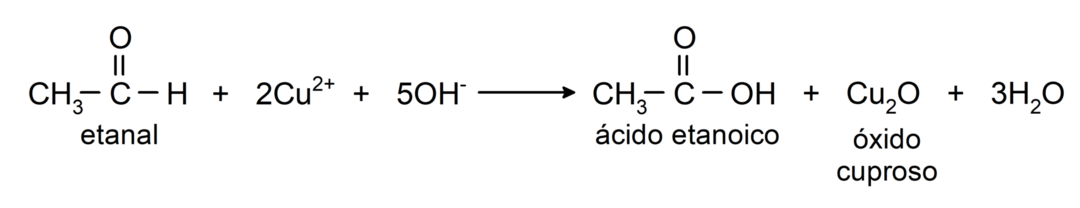
Ulegają reakcjom addycji nukleofilowej, to znaczy dodanie nukleofila do grupy karbonylowej. Na przykład:
- Dodatek kwasu cyjanowodorowego w celu wytworzenia cyjanohydryn lub cyjanohydryn.
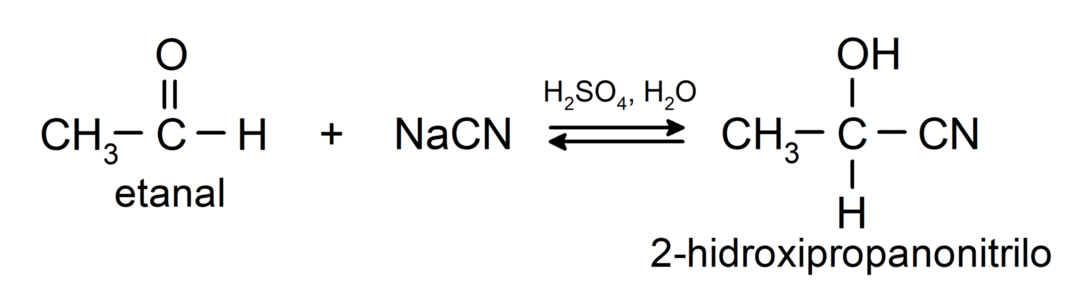
- W obecności bezwodnych kwasów do grupy karbonylowej aldehydów dodaje się alkohole, tworząc acetale i półacetale.
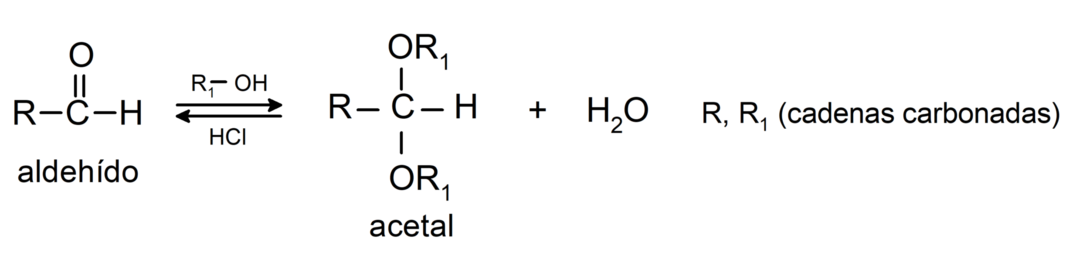
Ulegają reakcjom kondensacji aldolowej. W tych reakcjach połączenie dwóch aldehydów zachodzi w obecności wodorotlenku sodu (NaOH) i związek chemiczny powstały nazywa się aldolem. Na przykład:
- Reakcja kondensacji etanolu w obecności rozcieńczonego NaOH.
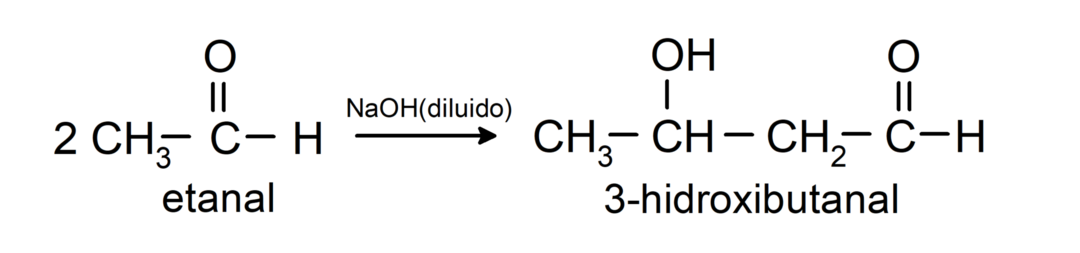
Są zredukowane do alkoholi pierwszorzędowych. Aldehydy można zredukować do alkoholi pierwszorzędowych poprzez uwodornienie katalityczne lub redukcję borowodorkiem sodu (NaBH2).4) i wodorek litowo-glinowy (LiAlH4).
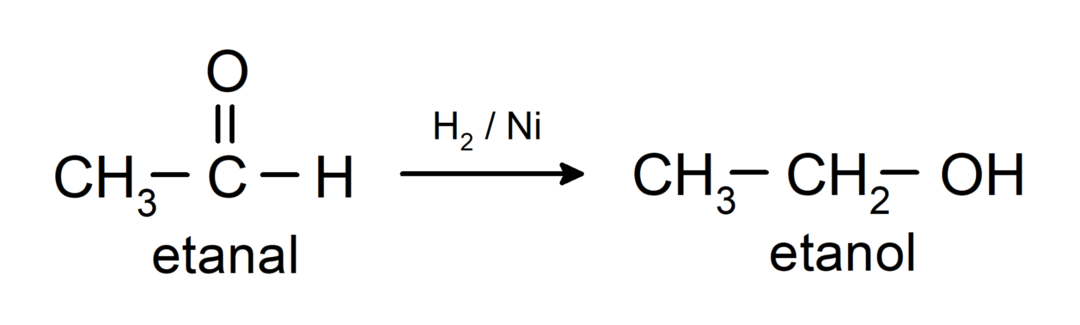
Właściwości chemiczne ketonów
Wśród właściwości chemicznych ketonów możemy znaleźć:
Ulegają reakcjom addycji nukleofilowej. Na przykład:
- Dodatek kwasu cyjanowodorowego w celu wytworzenia cyjanohydryn lub cyjanohydryn.
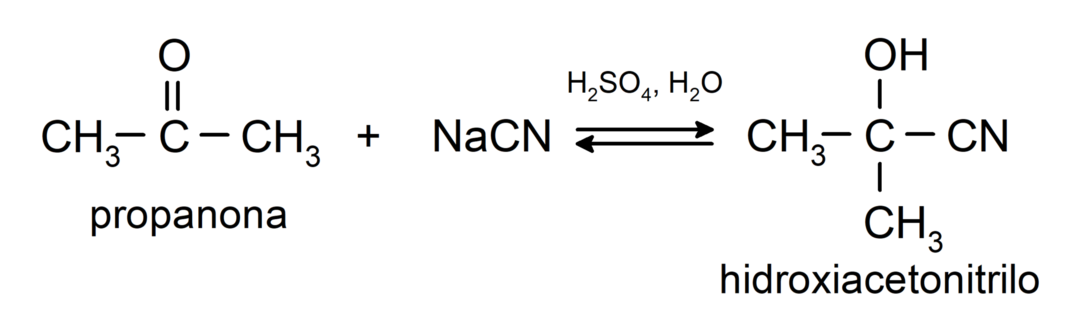
Dodają alkohole (w obecności bezwodnych kwasów) do grupy karbonylowej ketonów, tworząc ketale i hemiketale. Na przykład:
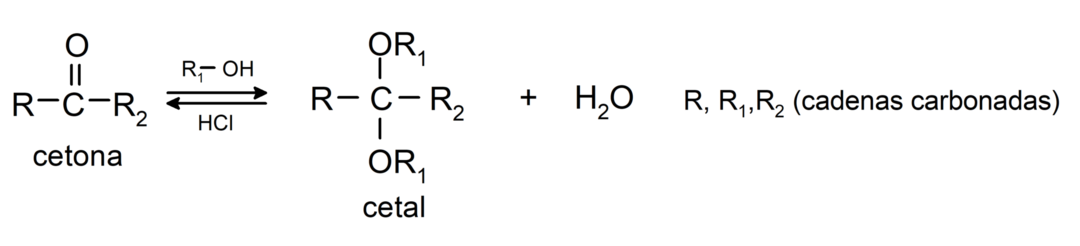
Ulegają reakcjom halogenowania. Ketony zawierające alfa wodór (α) reagują poprzez zastąpienie tego wodoru halogenami (chlor (Cl), brom (Br), jod (I), fluor (F)) w obecności katalizatorów kwasowych lub zasadowych. Substytucja zachodzi prawie wyłącznie w węglu α, czyli węgiel, który jest związany z wodorem α. Na przykład:
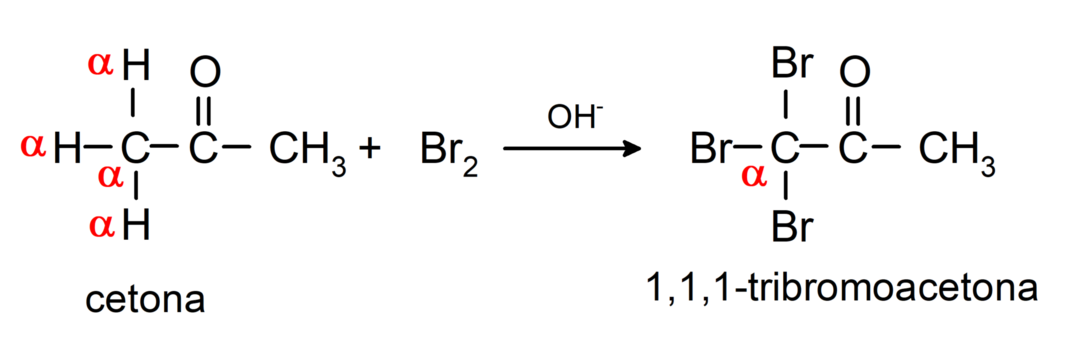
Są zredukowane do alkoholi wtórnych przez uwodornienie katalityczne lub redukcję borowodorkiem sodu (NaBH4) i wodorek litowo-glinowy (LiAlH4). Na przykład:
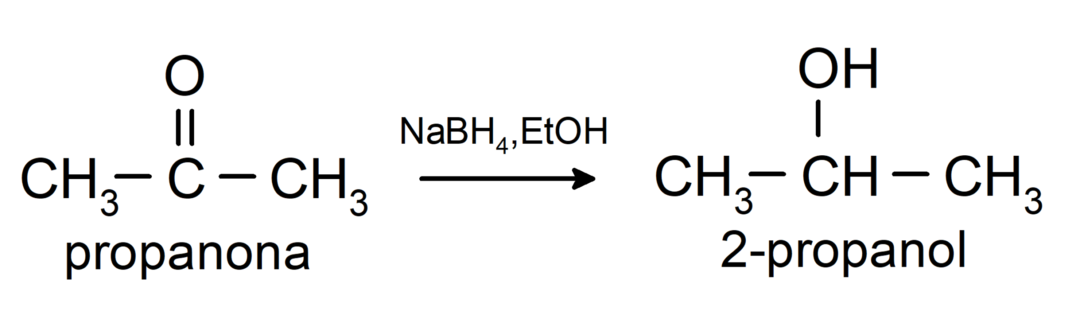
Ketony nie są utleniane przez odczynniki Tollensa i Benedicta.
Nazewnictwo aldehydów
Zgodnie z zasadami ustanowionymi przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC), Aldehydy nazywane są za pomocą przedrostków wskazujących liczbę atomów węgla w łańcuchu. gazowane. Nie jest konieczne określanie pozycji grupy karbonylowej, ponieważ zawsze znajduje się ona w pozycji pierwszej, na jednym końcu cząsteczki. Dodatkowo na końcu nazwy aldehydu zapisywany jest przyrostek -al. Na przykład:
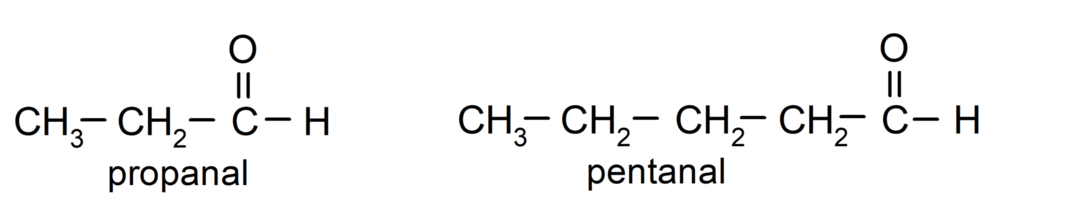
Jeśli aldehyd składa się z kilku łańcuchów węglowych, to znaczy ma rozgałęzienia, jako łańcuch główny wybiera się łańcuch węglowy z największą liczbą atomów węgla. Pozostałe łańcuchy nazywa się grupami podstawnikowymi, a położenie każdego podstawnika wybiera się tak, aby zajmował jak najmniejszą liczbę w łańcuchu. Ponadto atomy węgla zaczynają być liczone począwszy od końca, na którym znajduje się grupa karbonylowa. Na przykład:
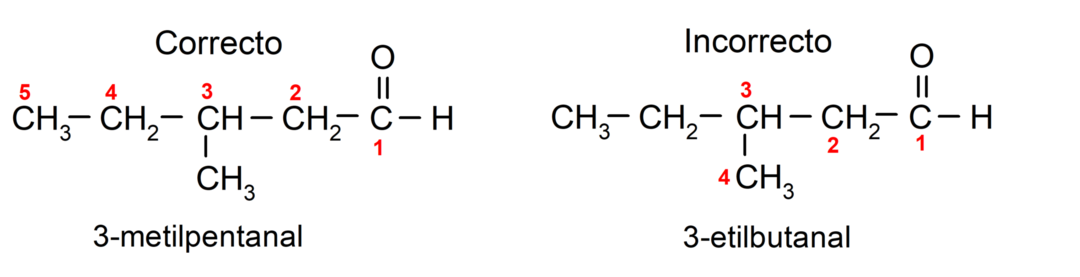
Aldehydy, które mają dwie grupy karbonylowe, nazywane są za pomocą przyrostka -dial. Na przykład:
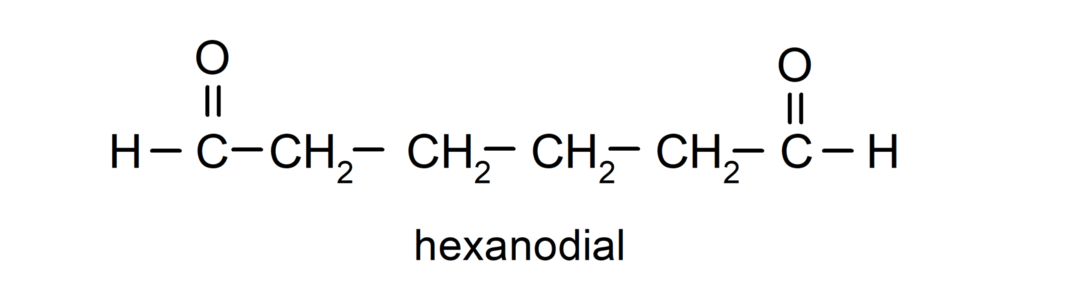
Nazewnictwo ketonów
Według Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC) ketony nazywa się za pomocą przedrostków wskazujących liczbę atomów węgla w łańcuchu węglowym.
Natomiast nazwę acetonu zapisuje się przyrostkiem -jeden, poprzedzonym liczbą wskazującą pozycję grupy karbonylowej w łańcuchu węglowym. Położenie grupy karbonylowej powinno być tak dobrane, aby odpowiadało możliwie najniższej numeracji. Na przykład:
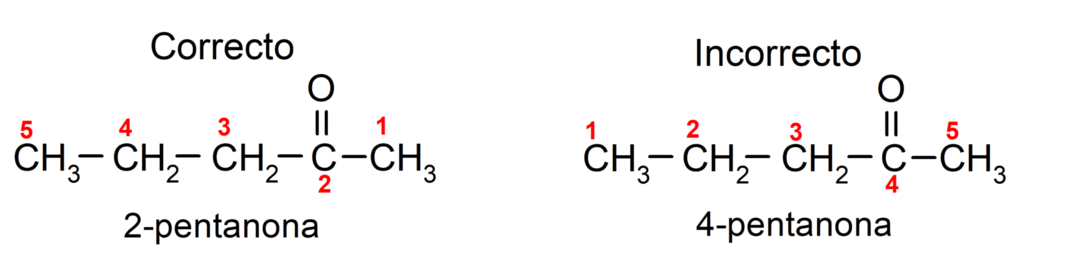
Aby nazwać keton składający się z kilku łańcuchów węglowych, czyli z rozgałęzieniami, wybieramy jako łańcuch główny, łańcuch węglowy z największą liczbą atomów węgla i zawierający grupę karbonyl. Pozostałe łańcuchy nazywane są grupami podstawnikowymi. Na przykład:
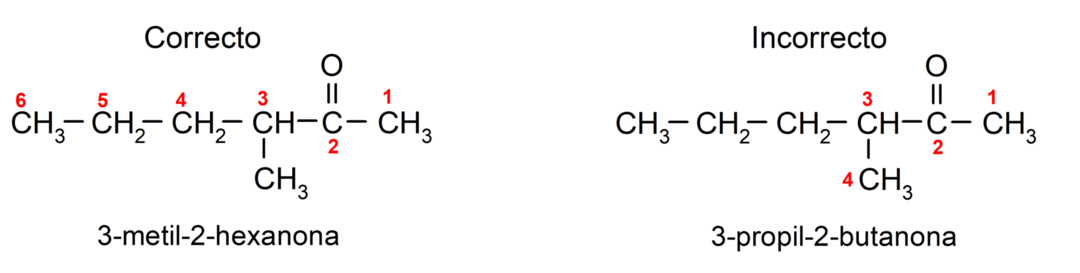
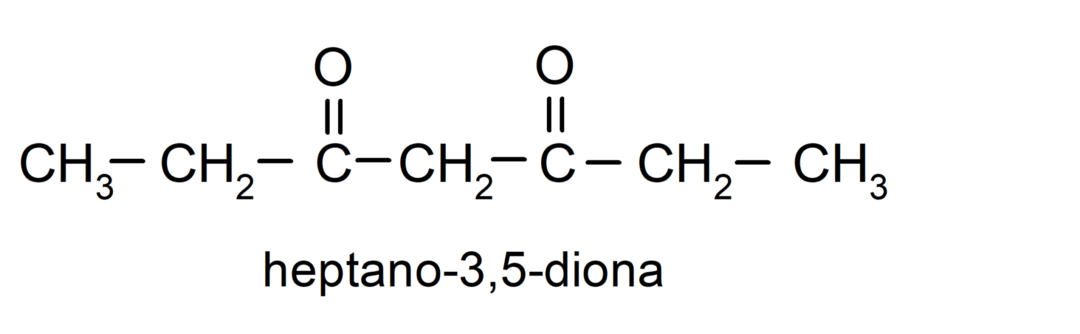
Istnieją ketony, które mają dwie grupy karbonylowe, nazywane są dionami. Na przykład:
Przykłady aldehydów
- metanal (formaldehyd)
- etanal (aldehyd octowy)
- propanal (propaldehyd)
- butanal
- pentanal
- heksanal
- 3-bromocyklopentanokarbaldehyd
- cykloheksanokarbaldehyd
- benzaldehyd
- 4,4-dimetylopentanal
- 2-hydroksy-butanal
- 2-hydroksy-2-metylo-butanal
- 2,3-dimetylopentanal
- pentanodialny
- 4-hydroksy-3-metoksybenzaldehyd
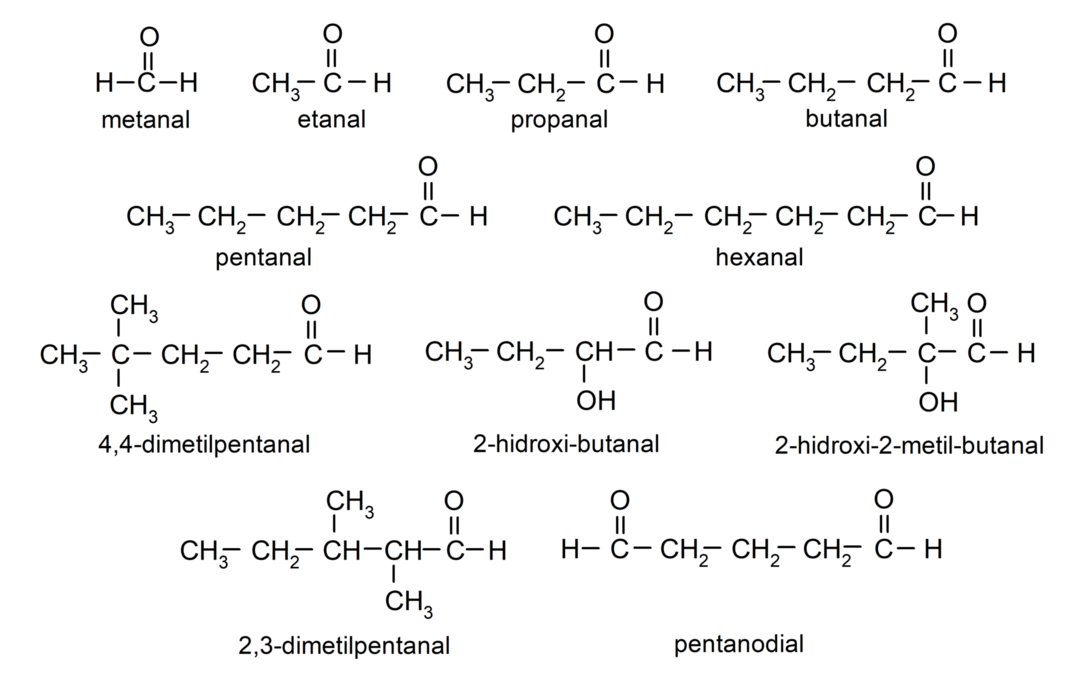
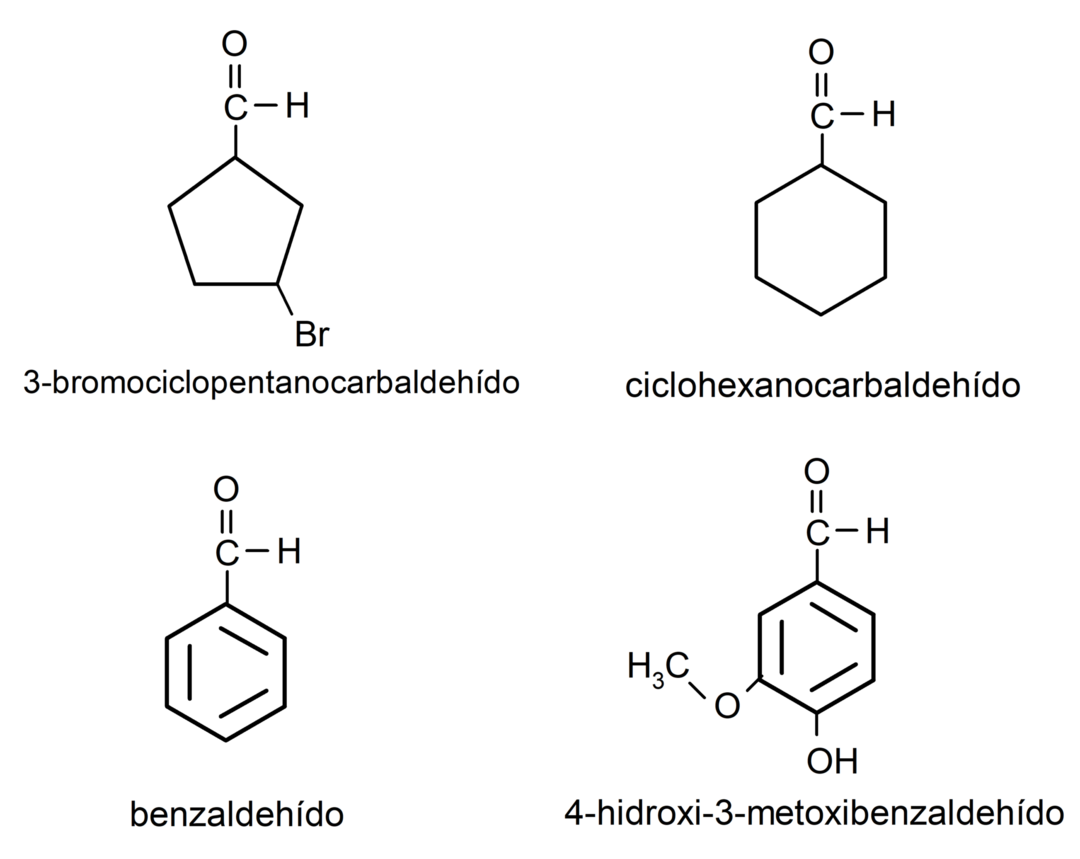
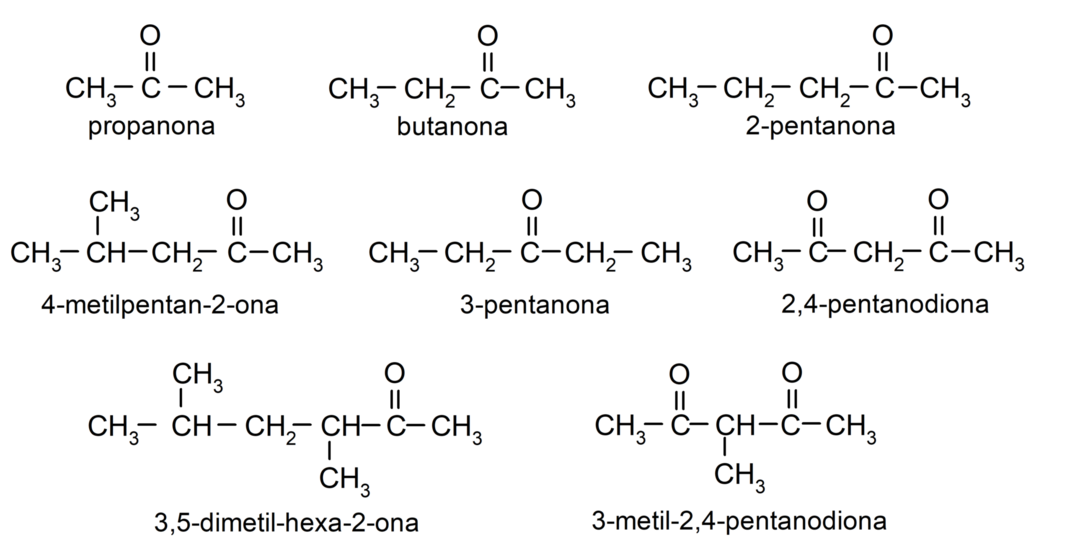
Przykłady ketonów
- propanon (aceton)
- butanon
- 2-pentanon
- 4-metylopentan-2-on
- 3-metylocykloheksanon
- keton cykloheksylometylowy
- 3,4 dimetylo-heksan-2-on
- keton etylowo-fenylowy
- 2,4-pentanodion
- cykloheksanon
- 3-pentanon
- 3-metylo-2,4-pentanodion
- 1-fenylopropanon
- cyklopentanon
- keton difenylowy
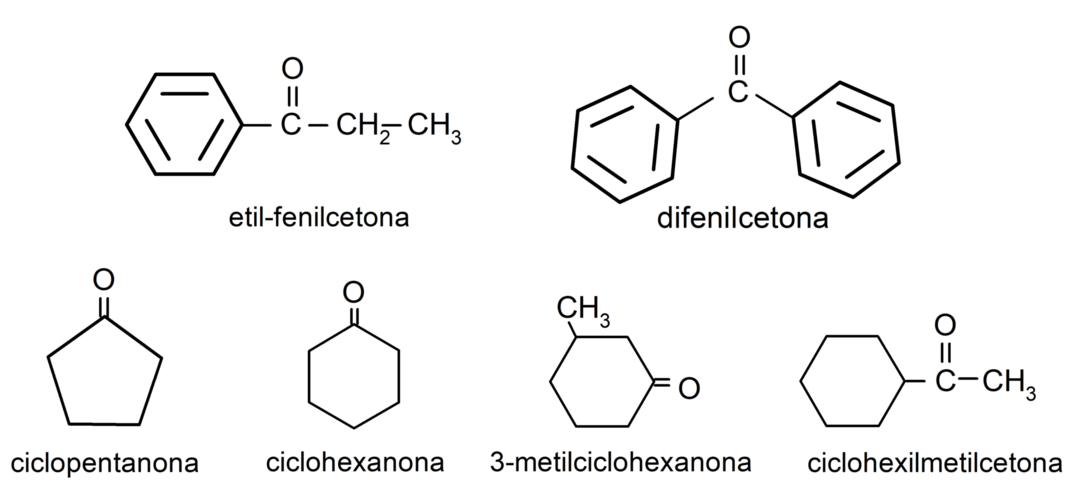
Zastosowanie aldehydów w życiu codziennym
Niektóre zastosowania aldehydów to:
- Wykorzystuje się je do produkcji rozpuszczalników, farb, perfum, żywic i esencji.
- Stosowane są jako środki konserwujące w produktach kosmetycznych, próbkach biologicznych i zwłokach. Do tych celów najczęściej stosuje się formaldehyd.
- Wykorzystuje się je do produkcji tworzyw sztucznych, które pozwalają na wymianę części metalowych w przemyśle motoryzacyjnym.
- Używa się ich jako aromatu do niektórych produktów spożywczych.
- Stosowane są jako środki dezynfekcyjne.
- Wykorzystywano je do produkcji niektórych materiałów wybuchowych, takich jak tetraazotan pentaerytrytolu (TNPE).
Zastosowanie ketonów w życiu codziennym
Niektóre zastosowania ketonów to:
- Wykorzystuje się je do produkcji rozpuszczalników. Szczególnie aceton jest szeroko stosowany do usuwania farb i lakierów.
- Wykorzystuje się je do produkcji niektórych gum i smarów.
- Wykorzystuje się je do produkcji farb, lakierów i lakierów.
- Wykorzystuje się je do produkcji leków i kosmetyków.
Toksyczność aldehydów i ketonów
- Aldehydy. Kontakt z aldehydami powoduje podrażnienie skóry, oczu i dróg oddechowych. Ponadto narażenie na aldehydy powiązano z chorobami takimi jak rak, kontaktowe zapalenie skóry, choroby wątroby i choroby neurodegeneracyjne. Na przykład formaldehyd jest uważany przez WHO (Światową Organizację Zdrowia) za związek rakotwórczy.
- ketony. Powtarzające się narażenie na ketony może powodować uszkodzenie centralnego układu nerwowego. Może to prowadzić do utraty pamięci, osłabienia, bólów i skurczów mięśni. Dodatkowo w przypadku kontaktu skóry z ketonami dochodzi do wysuszenia i pęknięć. Z drugiej strony, w przypadku wdychania ketonów dochodzi do podrażnienia dróg oddechowych i kaszlu.
Bibliografia
- Llorens Molina, JA. (2018). “Aldehydy i ketony: kilka przykładów.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) „Odczynnik Tollensa: od identyfikacji aldehydów do ich zastosowania w nanotechnologii. Aspekty historyczne i zastosowania dydaktyczne."Tom. 111 Nie. 3. Królewskie Hiszpańskie Towarzystwo Chemii.
- William Bauer, Jr. (2000) «Kwas metakrylowy i pochodne» w Encyklopedii chemii przemysłowej Ullmanna 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- „Ujawniają nowy mechanizm toksyczności w grupie związków rakotwórczych pochodzących z diety i środowiska” (2022) W: www.conicet.gov.ar Dostępne w: https://www.conicet.gov.ar/ Dostęp: 20 czerwca 2023 r.
Postępuj zgodnie z:
- Alkohole
- Cukry
- Alkany

