20 przykładów amidów
Przykłady / / November 06, 2023
The amidy Czy organiczne związki chemiczne pochodne kwasów karboksylowych, w których grupa hydroksylowa (-OH) grupy karboksylowej (-COOH) kwasu jest zastąpiona grupą aminową (-NH2, -NH-R, -N-(R)2, R oznacza dowolny łańcuch węglowy).
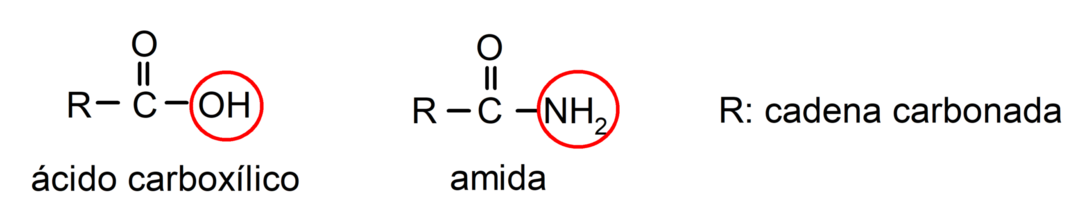
Amidy są organiczne molekuły zawierające grupę amidową składającą się z grupy karbonylowej i grupy aminowej. Na przykład: etanoamid, propanamid i N-metyloetanoamid.

- Zobacz też: Aldehydy i ketony
Rodzaje amidów
Amidy można klasyfikować według liczby wodorów (przyłączonych do azotu grupy aminowej), które zostały zastąpione różnymi grupami podstawnikowymi. W tym sensie istnieją amidy pierwszorzędowe, drugorzędowe i trzeciorzędowe.
- Pierwszorzędowe amidy. Są to amidy, które nie mają podstawionych wodorów grupy aminowej. Na przykład:

- Drugorzędowe amidy. Są to amidy, które mają podstawiony jeden z wodorów grupy aminowej. Na przykład:

- Trzeciorzędowe amidy. Są to amidy, które mają podstawione dwa atomy wodoru w grupie aminowej. Na przykład:

Nazewnictwo amidów
Zgodnie z powszechną nomenklaturą amidy nazywane są pochodnymi kwasów karboksylowych zgodnie z następującymi zasadami:
- Węgiel odpowiadający grupie karbonylowej znajduje się w pozycji 1 i spośród tego węgla wybierany jest najdłuższy łańcuch węglowy. Na przykład:

- Nazwy pierwszorzędowych amidów stosuje się przedrostkiem odpowiadającym liczbie atomów węgla kwasu karboksylowego, z którego powstały. Na przykład:

Według Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC): aminy Nazywa się je według następujących zasad:
- Nazwy amidów drugorzędowych i trzeciorzędowych stosuje się przedrostkiem odpowiadającym liczbie atomów węgla kwasu karboksylowego, z którego powstały. Ponadto dla każdego wodoru grupy aminowej, która została podstawiona, umieszcza się N. W ten sposób nadawane są nazwy różnym podstawnikom, wskazując ich ilość, a na końcu nazwy umieszcza się słowo amid. Na przykład:

- Gdy cząsteczka ma grupy priorytetowe w stosunku do grupy amidowej, wówczas amid nazywa się podstawnikiem. W takich przypadkach grupa amidowa nazywana jest karbamoilem. Na przykład:
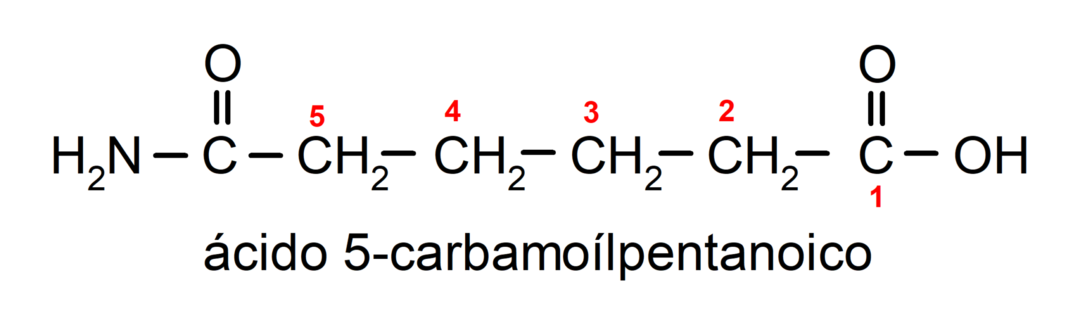
- Gdy cząsteczka jest utworzona przez cykl i grupę amidową, cykl jest traktowany jako główny łańcuch i umieszczany jest przyrostek -karboksamid. Na przykład:

Właściwości fizyczne amidów
- Amidy są stałe w temperaturze pokojowej, z wyjątkiem metanoamidu.
- Mają wysokie temperatury wrzenia, nawet wyższe niż odpowiadające im kwasy karboksylowe.
- Amidy są dobrymi rozpuszczalnikami.
- Są to słabe zasady.
Reakcje chemiczne amidów
- Amidy reagują z wodnym kwasem, tworząc odpowiedni kwas karboksylowy i sól amonową. Na przykład:

- Amidy reagują z zasadą, tworząc odpowiedni kwas karboksylowy i sól karboksylanową. Na przykład:
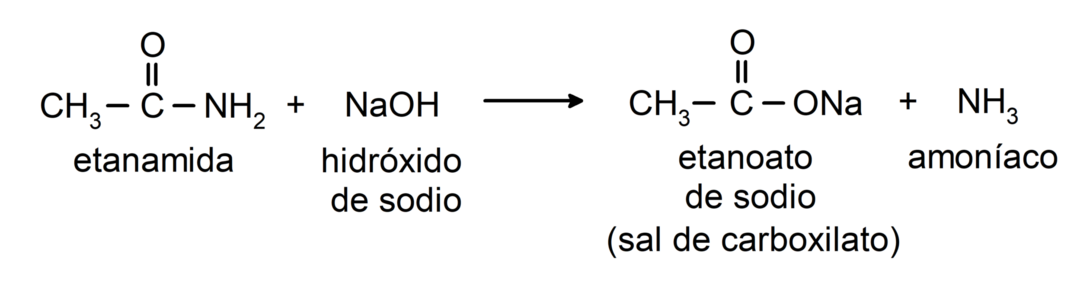
- Amidy są redukowane do amin w obecności tetrawodorku litowo-glinowego:
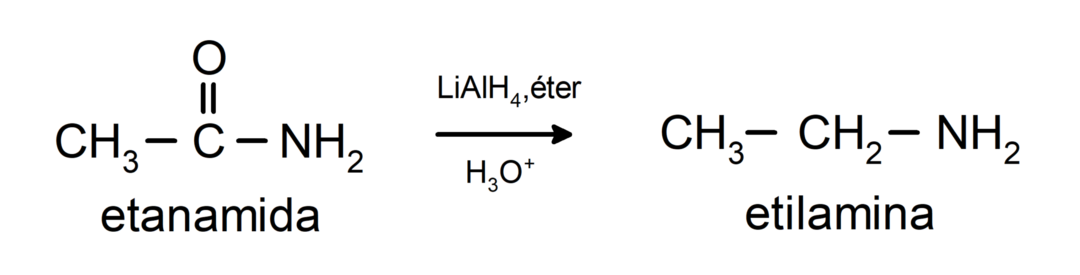
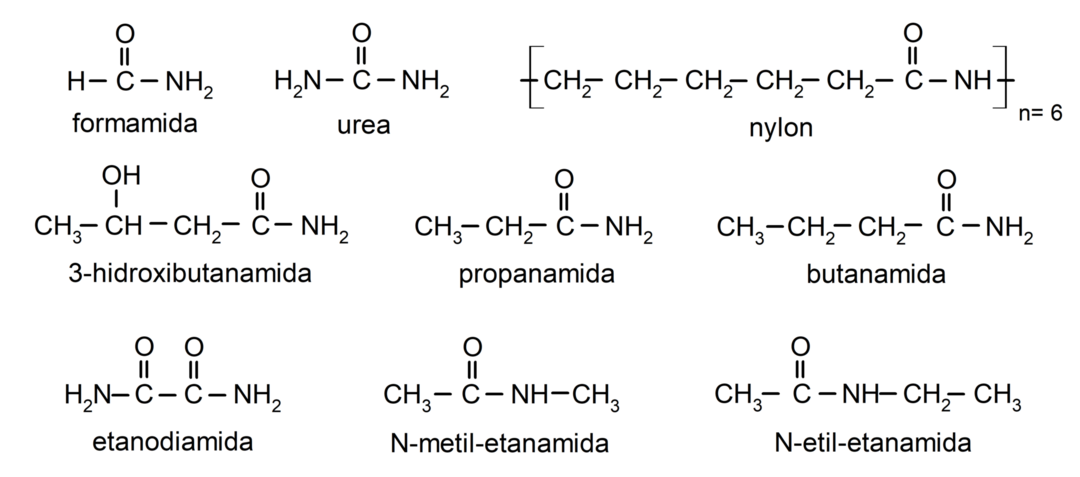
Przykłady amidów
- formamid
- mocznik
- nylon
- ε-kaprolaktam
- etanoamid
- propanamid
- butanamid
- etanodiamid
- N-metyloetanoamid
- N-etyloetanoamid
- N-propyloetanoamid
- N, N-dimetylobutanamid
- benzenokarboksyamid
- 4-bromo-3-metylocykloheksanokarboksyamid
- 3-hydroksybutanamid

Zastosowanie amidów
Amidy są szeroko stosowane w przemyśle farmaceutycznym. Ponadto są stosowane jako komponenty uwalniające formy w przemyśle tworzyw sztucznych. Z drugiej strony stosuje się je jako emulgatory, środki powierzchniowo czynne i rozpuszczalniki. Na przykład mocznik jest amidem szeroko stosowanym w przemyśle farmaceutycznym i przemyśle nylonowym.
Bibliografia
- Ramírez-Barrón, S. N., Sáenz-Galindo, A., López-López, L., & Cantú-Sifuentes, L. (2013). Amidy, zastosowanie i synteza. Magazyn naukowy Uniwersytetu Autonomicznego w Coahuila, 5(9).
- Caglieri, S. C. i Pagnan, M. (2013). Teoretyczne badania hydrolizy kwasowej amidów alifatycznych i aromatycznych. Informacje technologiczne, 24(3), 35-40.
- Martinez, C. H. M., Gomez, L. I. P., de Escobar, M. S. i Escalante, F. DO. (2002). Chemia organiczna. Uniwersytet Las Palmas de Gran Canaria, Prorektorat ds. Studiów i Jakości Nauczania.
Postępuj zgodnie z:
- Aldehydy
- Alkohole
- Makroelementy i mikroelementy
- Związki organiczne i nieorganiczne
