Przykład pierwiastków chemicznych
Chemia / / July 04, 2021
Pierwiastek chemiczny jest to czysta substancja składająca się z atomów tego samego typu, z kolei powstały przez liczbę protonów i neutronów w jądrze, a ilość elektrony na swoich orbitalach. Niektóre występują naturalnie, inne poprzez tworzenie cząsteczek związku, a jeszcze inne zostały stworzone poprzez wykonanie procedur laboratoryjnych. Wszystkie pierwiastki chemiczne tworzą materię całego wszechświata oraz podtrzymują istnienie i funkcjonowanie ludzkiego ciała.
każdy element posiada cechy i zachowania, które go wyróżniają i czynią wyjątkowym, ale jednocześnie przedstawia podobieństwa z grupą elementów w przejawach, które mają w wszechświat. Z tego powodu istnieje Układ Okresowy Pierwiastków Chemicznych, który odnosi się do tych podobieństw, aby spójnie pogrupować pierwiastki i ułatwić badanie ich właściwości.
Liczba atomowa elementu
Atom niesie w jądrze pewną liczbę protonów, którym towarzyszy taka sama liczba neutronów. Do tego numeru nazywa się to liczbą atomową, reprezentowane jako
Z do celów akademickich oraz w literaturze. Dla każdego elementu numer ten będzie unikalny. Nie ma dwóch elementów o tej samej liczbie atomowej. Układ okresowy również skupia się na tym kryterium przy ich porządkowaniu.Symbol elementu
W czasach Alchemii, które obejmują około 400-1000 AD. C., Alchemicy nagrywali swoje eksperymenty przypisując symbole do żywiołów. Były to proste symbole, wykonane z figur geometrycznych, reprezentujące poszczególne elementy i badane przekształcenia.
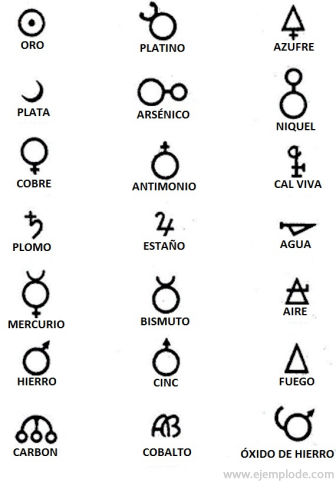
Kilka przykładów symboli alchemicznych wraz z nazwą pierwiastka lub związku, który reprezentują.
W epoce nowoczesnej chemii elementy są nadal przedstawiane za pomocą symboli, w tym przypadku liter, które odnoszą się do ich nazwy w języku łacińskim lub angielskim.
Na przykład:
Symbol sodu to Na, pod swoją łacińską nazwą Sód
Symbolem złota jest Au, pod swoją łacińską nazwą Aurum
Symbolem srebra jest Ag, pod swoją łacińską nazwą Argentum
Symbolem miedzi jest Cu, pod swoją łacińską nazwą Cuprum
Symbolem Antymonu jest Sb, pod swoją łacińską nazwą Stibium
Symbolem żelaza jest Wiara, pod swoją łacińską nazwą Ferrum
Symbolem Merkurego jest Hg, pod swoją łacińską nazwą Hydrargyrum, co oznacza „płynne srebro”
Symbolem potasu jest K, pod swoją łacińską nazwą Kalium
Grupy pierwiastków chemicznych:
Układ Okresowy Pierwiastków Chemicznych dzieli je na grupy: grupy A i grupy B. Grupy A to osiem, które zawierają elementy Alkaliczny, alkaliczno-ziemisty, Terreos, trzy rodziny Elementów, których głowa określa nazwę rodziny: Rodzina węgla, Rodzina azotowa, Rodzina siarki, Halogeny i Gazy szlachetne. Grupy B składają się ze wszystkich Metale przejściowe i Rzadkie Ziemie, które są również dwiema wielkimi Rodzinami: Lantanowce Tak aktynowce.
Grupa IA: Pierwiastki alkaliczne:
Seria pierwiastków alkalicznych składa się z wodoru (H), litu (Li), sodu (Na), potasu (K), rubidu (Rb), cezu (Cs) i francu (Fr). Wszystkie mają taką konfigurację elektroniczną, że w ostatniej powłoce mają elektron. Ich nazwa wynika z faktu, że w kontakcie z wodą reagują tworząc zasady lub wodorotlenki. Jest to ogólne zachowanie między tymi elementami. Im większy atom pierwiastka, tym bardziej jest reaktywny, ponieważ siła, z jaką jądro zatrzymuje elektron z ostatniej powłoki, ma coraz mniejszy zasięg. Są zdolne do tworzenia wiązań jonowych z halogenami. Na przykład: Wiązanie jonowe, które ma dużą obecność, to wiązanie sodu-chloru, tworzące chlorek sodu NaCl.
Grupa IIA: Pierwiastki ziem alkalicznych:
Te pierwiastki to: beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra). Nie są z natury wolne; z drugiej strony jego węglany i krzemiany występują we względnej obfitości. Są argentyńsko białe i krystaliczne. Łatwo łączą się z tlenem pod wpływem powietrza. Wynika to częściowo z faktu, że mają one w swojej ostatniej powłoce dwa elektrony, co jest zgodne ze zdolnością przyjmowania tlenu. Bar jest najbardziej aktywnym pierwiastkiem grupy i wraz z wapniem jest to ten, który ma najwięcej zastosowań przemysłowych w grupie.
Grupa IIIA: Elementy ziemi:
Grupa IIIA obejmuje pierwiastki Bor (B), Aluminium (Al), Gal (Ga), Ind (In) i Tal (Tl). Bor jest pierwiastkiem niemetalicznym, Aluminium jest amfoteryczne (amfiprotyczne), to znaczy może działać jako kwas i jako zasada; a pozostałe trzy to pierwiastki metaliczne. Mają trzy elektrony w swojej ostatniej powłoce, generując wartościowość +3, chociaż czasami gal działa z wartościowością +1 i +2 w niektórych swoich związkach. Bor jest jedynym pierwiastkiem z tej serii, który tworzy Wody. Bor i aluminium tworzą węgliki.
Grupa IVA: Rodzina węgla:
Reprezentatywnymi elementami grupy IVA są węgiel (C), krzem (Si), german (Ge), cyna (Sn) i ołów (Pb). Pierwsze dwa są zasadniczo niemetaliczne w swoich właściwościach, ale german, cyna i ołów są metaliczne, a tym bardziej, im wyższa jest ich liczba atomowa. Z wyjątkiem krzemu każdy pierwiastek ma wartościowości +4 i +2.
Węgiel i krzem tworzą związki, w których atomy pierwiastków są połączone parami wspólnych elektronów. Węgiel jest esencją związków organicznych, kojarząc się z atomami wodoru, tlenu, azotu, siarki, a czasem krzemu.
Do produkcji elementów elektronicznych używa się krzemu i germanu, ponieważ mają one właściwość zachowywania się jak półprzewodniki.
Grupa VA: Rodzina azotowa:
Grupa VA obejmuje pierwiastki azot (N), fosfor (P), arsen (As), antymon (Sb) i bizmut (Bi). Azot i fosfor są niemetalami, arsen i antymon są metaloidami, a bizmut jest metalem. Pierwiastki te charakteryzują się tworzeniem wodorków, z których najmniej toksyczny jest amoniak NH3. Formy azotu Kwas azotowy HNO3, razem z kwasem solnym w Agua Regia, mieszaniną zdolną do rozpuszczania metali szlachetnych, takich jak złoto i srebro.
Azot jest również zaangażowany w dwie duże grupy związków organicznych zwanych aminami i amidami, które można uznać za pochodne amoniaku NH3, przez zastąpienie wodoru łańcuchem węglowodorowym.
Grupa VIA: Rodzina tlenowa:
Składa się z pierwiastków tlen (O), siarka (S), selen (Se), tellur (Te) i polon (Po). Tlen jest najbardziej aktywny i ma zdolność łatwego tworzenia wiązań kowalencyjnych. W kontakcie z metalami w środowisku o dużej wilgotności tworzy tlenki. Tworzy rezonansową cząsteczkę zwaną ozonem, która chroni planetę przed promieniowaniem UV.
Grupa VIIA: Halogeny:
Jego nazwa oznacza „Formatorów Sprzedaży”. Grupa składa się z pierwiastków fluoru (F), chloru (Cl), bromu (Br), jodu (I) i astanu (At). W ostatniej powłoce mają siedem elektronów, co pozwala im być receptorami dla jednego elektronu. Ta jakość sprawia, że łączą się z elementami grupy IA, tworząc sole binarne. Fluor charakteryzuje się największą elektroujemnością całego układu okresowego, o wartości 4,0, której odpowiednikiem jest cez, z elektroujemnością 0,7. Ta właściwość pozwala mu mieć siłę przyciągania innych atomów i dawać pierwszeństwo w tworzeniu wiązania z one.
Grupa VIIIA: Gazy Szlachetne:
Nazywany również Grupą Gazów Obojętnych, składa się z pierwiastków Hel (He), Neon (Ne), Argon (Ar), Krypton (Kr), Ksenon (Xe) i Radon (Ra). Są to elementy, które mają całą swoją konfigurację elektroniczną, więc nie są w stanie reagować w zwykłych warunkach. Stosowane są głównie do świetlnych znaków handlowych, emitujących światło widzialne, gdy pada na nie prąd elektryczny.
Grupy B: Metale przejściowe:
W dziesięciu grupach po trzy pierwiastki każda, metale przejściowe są pogrupowane. Należą do nich najlepsze przewodniki elektryczne: Srebro (Ag), Miedź (Cu), Złoto (Au); najlepsze elementy konstrukcyjne dla budownictwa miejskiego i inżynierii; Żelazo (Fe), Tytan (Ti), Aluminium (Al), Cyrkon (Zr), Wolfram (W); najlepsze składniki katalizatora: Nikiel (Ni), Wanad (V), Platyna (Pt); oraz główne składniki powłoki: Kadm (Cd), Chrom (Cr), Cynk (Zn). Zwykle obsługują wartościowości od +1 do +3, ale elementy takie jak Chrom obsługują wartościowości +2, +3, +6.
Ziemie rzadkie: lantanowce i aktynowce:
Nazywa się je Rzadkimi Ziemiami ze względu na ich niedobór na planecie. Składają się z dwóch grup: lantanowców i aktynowców. Znajdują się one w dwóch oddzielnych wierszach układu okresowego. Działają ogólnie z wartościowością +3 i mają tendencję do tworzenia wodorotlenków. Najważniejszym pierwiastkiem wśród nich jest Cer, który jest używany do przygotowania stopów piroforycznych (Alloy Miszmetal, do lżejszych kamieni), w wężach gazowych do oświetlenia oraz w produkcji specjalnych szkieł pochłaniających promienie ultrafioletowe i promieniowanie cieplne.
Do tych grup należą najpotężniejsze pierwiastki promieniotwórcze, takie jak uran (U) i pluton (Pu). które biorąc pod uwagę ich niestabilność, uwalniają energię i rozpadają się, tracąc cząstki alfa (jądra Hel). Później, zgodnie z serią radioaktywną, stają się mniej niestabilnymi pierwiastkami.
