Przykład analizy wolumetrycznej
Chemia / / July 04, 2021
Na Chemia analityczna, Wolumetria jest metodą analizy, która składa się z Pomiar objętości odczynnika potrzebnej do stechiometrycznej reakcji z analitem, która jest substancją do ustalenia.
Reaguj stechiometrycznie odnosi się do substancji oddziałujących chemicznie, zgodnie z proporcja, która oznacza równanie chemiczne już zrównoważony.
Badana substancja nazywa się Analityka. Z tej substancji jako próbkę zostanie pobrana znana i dokładnie zmierzona objętość, którą nazwiemy Podwielokrotność, zawarty w kolbie Erlenmeyera, aby rozpocząć analizę.
Koncepcje analizy objętościowej
Analiza wolumetryczna, będąca rodzajem Analiza chemiczna, nieść brał udział w reakcji chemicznej. Ta reakcja chemiczna będzie zachodziła pomiędzy próbką o nieznanej ilości badanej substancji a znaną ilością innej substancji zdolnej do reagowania z tą pierwszą.
Substancje reakcyjne będą w roztworze wodnym, a objętości roztworów, które oddziaływały do końca reakcji, zostaną zmierzone, co będzie widoczne dzięki wskaźnikowi, który nada kolor wewnątrz kolby.
W analizie wolumetrycznej wodny roztwór Znane stężenie nazywa się roztworem standardowym, Standardowy lub Titrant, i posłuży jako punkt odniesienia, kończący reakcję, do wykonania obliczeń, które ujawnią ilość badanej substancji.
Ta procedura wywołania reakcji obu rozwiązań nazywa się Stopień chemiczny o Wycena, która jest podstawową częścią analizy wolumetrycznej. Składa się z chodzenia stopniowe wlewanie roztworu standardowego (Titrant) w alikwocie (Próbka), aż wskaźnik pokaże zmianę z różnicą kolorów.
ZA Wskaźnik Jest to substancja chemiczna, która jest dodawana do alikwotu, wykazując zabarwienie i która po zakończeniu reakcji zmieni kolor.
Analiza wolumetryczna składa się z prostej serii kroków:
1.- Przygotowanie roztworu wzorcowego
2.- Przygotowanie próbki lub porcji
3.- Stopień chemiczny
4.- Pomiar objętości
5.- Obliczanie badanej substancji.
Do momentu, w którym już to zrobili w pełni zareagował dwie substancje, nazywa się to Punkt równoważności.
Jak w każdej chemicznej metodzie analizy, w analizie wolumetrycznej istnieją wymagania dotyczące dobrych wyników:
-Reakcja chemiczna musi być Selektywnyto znaczy, że roztwór wzorcowy będzie reagował tylko z próbką.
-Reakcja chemiczna musi być stechiometryczny, to znaczy przestrzegać proporcji zaznaczonych w zrównoważonym równaniu chemicznym.
-Reakcja chemiczna musi być Ilościowy; odnosi się do 99,9% ukończenia w punkcie równoważnikowym.
- Musi być wykrywalny punkt końcowy w reakcji, co lepiej potwierdzi wskaźnik.
Podstawowy wzór
Podstawowe wzorce Są to substancje o wysokiej czystości, których stężenie w roztworze oblicza się bezpośrednio z naważonej ilości i zużytej objętości wody.
A) Tak, można reagować z roztworami roboczymi, aby poznać stężenia tych ostatnich i przekształcić je w roztwory wzorcowe.
Przykładami wzorców podstawowych są:
-Węglan sodu (Na2WSPÓŁ3): Stosowany do standaryzacji kwasów, takich jak kwas siarkowy.
- Dwuftalan potasu: Jest to podstawowy standard do przygotowania standardowych roztworów zasad, takich jak wodorotlenek sodu.
-Chlorek sodu (NaCl): Służy do standaryzacji roztworów azotanu srebra.
-Węglan wapnia (CaCO3): Podstawowy wzorzec dla EDTA (kwas etylenodiaminotetraoctowy).
Wzorzec Podstawowy musi spełniać kilka zasadniczych cech:
Musi mieć Wysoka czystość, Stabilność atmosfery, Brak wody nawadniającej, Niski koszt i łatwy do zdobycia, Y Wysoka waga równoważna.
Klasyfikacja analizy wolumetrycznej
W zależności od gatunku chemicznego, z którym przeprowadzana jest analiza, będzie to rodzaj wolumetrii:
Wolumetria kwasowo-zasadowa: Działa zarówno z kwasem, jak i z zasadą, aby analizować próbki zawierające kwasy lub zasady.
Wolumetria opadów: Zwana także argentometrią, wykorzystuje standardowy roztwór azotanu srebra do określenia ilości chlorków w próbce.
Wolumetria złożoności: Do pomiaru stężenia twardości, czyli węglanów wapnia i magnezu, w wodzie stosuje się standardowy roztwór środka kompleksującego, takiego jak EDTA.
Wolumetria REDOX: Reakcja zachodzi pomiędzy substancją utleniającą a substancją redukującą.
Wskaźniki
Spośród licznych wskaźników stosowanych w Wolumetrii wyróżniają się trzy:
1.- Oranż metylowy: Próbka ma pomarańczowe zabarwienie, które zostanie zmiareczkowane kwasem. Po osiągnięciu punktu równoważności wskaźnik zmieni kolor na żółty.
2.- Fenoloftaleina: Jest przezroczysty na początku w alikwocie, który będzie zatytułowany bazą. Po osiągnięciu punktu równoważności wskaźnik zmieni kolor na różowy.
3.- Czerń eriochromowa: Jest to wskaźnik używany do określenia twardości wody. Na początku jest fioletowy w porcji, dopóki nie zostanie zmiareczkowany środkiem kompleksującym. Pod koniec reakcji zmienia kolor na niebieski.

Instrumenty w analizie wolumetrycznej
W analizie wolumetrycznej zostanie użyty szereg instrumentów, które, jeśli nie są dostępne, nie mogą być odpowiednio rozwinięte:
1.- Kolba miarowa: Jest to pojemnik podobny do bańki w dolnej części, spłaszczony u dołu, z cienką kolumną, do której dodaje się płyn. Posiada znak wskazujący, gdzie powinien znajdować się menisk cieczy, aby obejmował dokładną objętość. Służy do przechowywania roztworów standardowych; dzięki dokładności jego objętości zapewnione jest znane stężenie.

2.- Pipety: Cienkie rurki z podziałką, które pozwalają na dokładny pomiar ilości cieczy. Są dostępne do 25 mililitrów i umożliwiają dokładne pobieranie próbek.
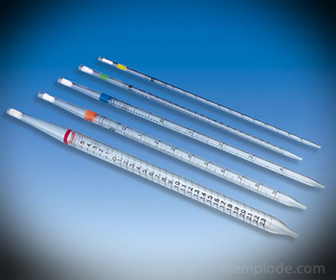
3.- Biureta: Jest to wydłużona rurka o pojemności 50 mililitrów, która będzie zawierać roztwór standardowy. Na jednym z końców ma zawór regulujący przepływ, który spuszcza roztwór do porcji.
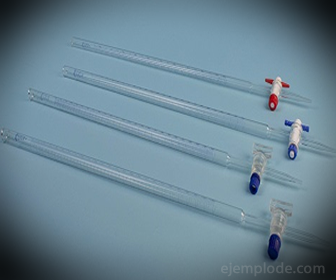
4.- Kolby Erlenmeyera: Są to pojemniki z płaską podstawą, stożkowym kształtem zakończonym cylindryczną krawędzią. Taka konstrukcja sprawia, że nadają się do miareczkowania chemicznego, ponieważ nie pozwalają na przepełnienie roztworów przez wstrząsanie. Co najmniej trzy będą wymagane, jeśli mają być wykonane powtarzane testy, aby zapewnić wiarygodny wynik.

Obliczenia w analizie objętościowej
Ponieważ roztwory wodne są obsługiwane, wielkościami istotnymi dla analizy wolumetrycznej są stężenie i objętość.
Główne równanie wolumetrii opiera się na czterech głównych danych:
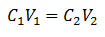
do1= Stężenie próbki (nieznane)
V1= Objętość alikwotu, z którą wykonano analizę
do2= Stężenie roztworu wzorcowego użyte do osiągnięcia punktu równoważnikowego
V2= Objętość roztworu wzorcowego potrzebna do osiągnięcia końca reakcji
Dane są podstawiane w równaniu, pozostawiając jedynie poszukiwane stężenie jako nieznane. Oczywiście wszystkie dane muszą znajdować się na tych samych dyskach.
Przykłady analizy wolumetrycznej
Oznaczanie chlorków (Cl-) metodą argentometryczną z azotanem srebra.
Oznaczanie bromków (Br-) metodą argentometryczną z azotanem srebra.
Oznaczanie cyjanków (CN-) metodą argentometryczną z azotanem srebra.
Oznaczanie węglanu magnezu (MgCO3), metodą kompleksometrii, z EDTA.
Oznaczanie węglanu wapnia (CaCO3), metodą kompleksometrii, z EDTA.
Analiza kwasu siarkowego (H2południowy zachód4) z wodorotlenkiem sodu (NaOH).
Analiza wodorotlenku sodu (NaOH) z kwasem solnym (HCl).
Oznaczanie antymonu (III) nadmanganianem potasu (KMnO4).
Oznaczanie arsenu (III) nadmanganianem potasu (KMnO4).
Oznaczanie tytanu (III) nadmanganianem potasu (KMnO .)4).
Oznaczanie molibdenu (III) nadmanganianem potasu (KMnO .)4).
Oznaczanie żelaza (II) nadmanganianem potasu (KMnO .)4).
Oznaczanie jonów szczawianowych nadmanganianem potasu (KMnO4).



