Przykład energii chemicznej
Chemia / / July 04, 2021
Energia chemiczna to ta, która pochodzi z reakcji chemicznych. Interakcja między indywiduami chemicznymi generuje zerwanie i/lub generowanie wiązań, co oznacza odpowiednio uwolnienie lub absorpcję Energii. Energia chemiczna nazywana jest energią uwolnioną, która może być wykorzystana na przykład jako energia cieplna i energia elektryczna.
Energia w reakcjach chemicznych
Energię chemiczną można uzyskać w swojej maksymalnej ekspresji z dwóch głównych źródeł: spalania i roztworów elektrolitycznych. Z drugiej strony na poziomie ludzkiego ciała możliwe jest pozyskiwanie energii poprzez chemiczny rozpad żywności.
Energia spalania
Na przykład, gdy paliwo metan CH4, najprostszy węglowodór, zaczyna się palić w obecności utleniacza tlenu, rozpada się, tworząc produkty dwutlenku węgla CO.2 i woda H2LUB. Ponadto zerwanie wiązań atomów wodoru z atomami węgla spowoduje uwolnienie energii w postaci ciepła.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2 O(l) ∆H = -212,8 Kcal/mol
Równanie spalania metanu. Ciepło tej reakcji jest reprezentowane przez ΔH. Znak ujemny wskazuje na uwolnienie Energii. Reakcja jest egzotermiczna.
 Spalanie metanu. Reakcja objawia się płomieniem.
Spalanie metanu. Reakcja objawia się płomieniem.
Przykłady Ciepła Spalania związków organicznych w 25°C.
Złożony |
Formuła |
ΔH (kcal/mol) |
Metan (g) |
CH4 |
-212.80 |
Etan (g) |
do2H6 |
-372.82 |
Propan (g) |
do3H8 |
-530.60 |
n-Butan (g) |
do4H10 |
-687.98 |
n-pentan (g) |
do5H12 |
-845.16 |
Etylen (g) |
do2H4 |
-337.23 |
Acetylen (g) |
do2H2 |
-310.62 |
Benzen (g) |
do6H6 |
-787.20 |
Benzen (l) |
do6H6 |
-780.98 |
Toluen (l) |
do7H8 |
-934.50 |
Naftalen (y) |
do10H8 |
-1,228.18 |
Sacharoza (y) |
do12H22LUB11 |
-1,348.90 |
Metanol (l) |
CH3O |
-173.67 |
Etanol (l) |
do2H5O |
-326.70 |
Kwas octowy (l) |
CH3COOH |
-208.34 |
Kwas(y) benzoesowy(e) |
do6H5COOH |
-771.20 |
Aby paliwo dostarczało całe ciepło spalania, do którego jest zdolne, musi być w stanie gazowym. Jak widać w tabeli, ciekły benzen zapewnia ciepło spalania, które jest o 6,22 Kcal/mol mniejsze niż wydzielane przez gazowy benzen. Oznacza to, że trzeba zainwestować 6,22 Kcal/mol, aby przejść z cieczy na gaz.
Kliknij, aby uzyskać więcej informacji na temat Paliwa.
Rozwiązania elektrolityczne Energia
Przewodnik elektrolityczny to ośrodek, w którym bierze udział jeden lub więcej rodzajów jonów, co oznacza rozproszony wraz z ładunkiem elektrycznym, dzięki czemu prąd elektryczny może przepływać przez jego Konstytucja. Roztwory elektrolityczne to przewodniki elektrolityczne.
Przewodniki elektrolityczne obejmują, oprócz roztworów elektrolitów, Sole stopione, a także niektóre sole stałe, takie jak chlorek sodu NaCl i azotan srebra AgNO3.
Przenoszenie elektronów następuje poprzez migrację jonów, dodatnich i ujemnych, w kierunku elektrod. Ta migracja obejmuje nie tylko transfer energii elektrycznej, ale także transport materii z jednej części przewodnika do drugiej.
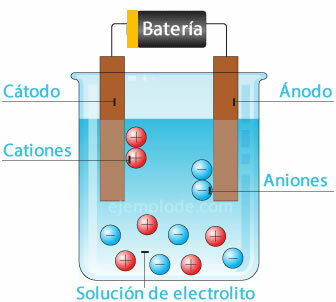 Ogniwo elektrochemiczne
Ogniwo elektrochemiczne
Podłączenie źródła potencjału do elektrod metalicznych (katody i anody) i zanurzenie ich w a W roztworze wodnym elektrony przejdą przez anodę, aby uciec z roztworu do dodatniego bieguna fontanna. Tak jest na przykład w przypadku jonu chlorku, który jest uwalniany ze swojego elektronu i już z ładunkiem obojętnym łączy się z innym atomem chloru, tworząc cząsteczkę dwuatomową. Gazowy chlor ucieknie z roztworu.
2Cl- = 2Cl + 2e-
Elektrony opuszczające ujemny biegun źródła zostaną umieszczone w zanurzonej katodzie. Indywidua obecne w roztworze wodnym (jony) zabiorą elektrony z katody. Na przykład jony wodoru tworzące wodę, będąc naładowanym dodatnim, przyjęły elektron, który ma zostać zneutralizowany i połączony z innym atomem wodoru, aby utworzyć cząsteczkę dwuatomowy. Ucieknie w postaci gazowego wodoru z roztworu.
2H+ + 2e- = 2H
2H = H2 (sol)
Ta wymiana elektronów może wspomagać pracę akumulatorów samochodowych, które składają się z elektrod ołowiowych Pb zanurzonych w roztworze kwasu siarkowego H2południowy zachód4.
Ta sama energia jest uzyskiwana we wszystkich typach akumulatorów, które są obsługiwane na poziomie krajowym: 9V, AA, AAA, D, żeby wymienić tylko kilka przykładów.
Energia żywności
Istoty ludzkie przyswajają energię, która jest uwalniana przez rozpad żywności, którą spożywamy w naszym ciele. Ta energia jest wykorzystywana przez nasze ciało do funkcji nieświadomych (trawienie, bicie serca, funkcje komórkowe) oraz tych, które wykonujemy.
Dopóki nie prowadzisz intensywnej aktywności fizycznej, a Twój metabolizm jest powolny, wskazane jest regularne spożywanie kalorii, ponieważ pokarmy bogate w Złożone lipidy i węglowodany, które mają bardzo duże struktury, są trudniejsze do rozbicia, co skutkuje odwróceniem Energia. W takim przypadku efekt byłby chwilowo odwrotny.
Wskazane jest spożywanie owoców, gdy musisz pracować w nocy, ponieważ owoce zawierają fruktozę, węglowodan prosty, który łatwo się rozkłada i będzie miał dostęp do energii po Twoim after konsumpcja.
Energia chemiczna i jej przemiany
Instalacje termoelektryczne
Paliwa ciężkie są stosowane w elektrowniach termoelektrycznych ze względu na wysoką i długotrwałą wartość opałową. Generalnie jest to olej opałowy (olej opałowy). Spalanie, które jest chemicznym etapem procesu, posłuży jako czynnik grzewczy dla kotła, który będzie wytwarzał parę nasyconą. Para ta wydostanie się pod ciśnieniem przez sieć dystrybucji pary i zacznie poruszać turbinami generatora. Urządzenia te będą wytwarzać energię elektryczną, aby zaopatrywać odpowiednią populację.
Energia chemiczna → Energia mechaniczna → Energia elektryczna
Eksploatacja w motoryzacji
Samochody są zależne od źródła zasilania, którym jest Akumulator. Wiadomo już, że w akumulatorze występuje przewodzenie elektrolityczne, które zasila układ zapłonowy, akcesoria deski rozdzielczej i pomocnicze gniazda zasilania. Dzięki tej dostępnej energii samochód będzie mógł się poruszać, by zabrać kierowcę w wybrane miejsce.
Energia chemiczna → Energia elektryczna → Energia mechaniczna



