Przykład chemii organicznej
Chemia / / July 04, 2021
Chemia organiczna Jest to dział Chemii Ogólnej zajmujący się badaniem i klasyfikacją funkcjonalną związków chemicznych, których elementem strukturalnym jest Węgiel, obecny w obfitości w żywa materia; Tworzy to bardzo zróżnicowane uniwersum Chemii Nieorganicznej, dedykowane związkom chemicznym zaliczanym do minerałów.
Atom węgla ma cztery elektrony w ostatniej powłoce swojej konfiguracji elektronicznej. Ta cecha, wraz z promieniem atomowym, pozwala na łączenie go wiązaniami kowalencyjnymi z innymi atomy tego samego pierwiastka, w licznych łańcuchach, tworzących ogromną różnorodność związków chemicznych stabilny.
Możesz sprawdzić Wiązania kowalencyjne.
Takie związki chemiczne, oprócz atomów węgla, które nadają im pierwotną strukturę, zawierają atomy wodoru jako główne uzupełnienie wartościowości węgla. Ponadto w tej różnorodności związków występują te z interwencją atomów tlenu, Azot, halogeny, siarka, a nawet fosfor, pierwiastki ziem alkalicznych i ziem alkalicznych oraz metale przejście. W zależności od tego, kto jest zaangażowany w cząsteczkę, będą to właściwości fizyczne i chemiczne końcowej substancji.
związki organiczne są obecne przez cały czas żywa materia; promować i podtrzymywać wszystko funkcje biologiczne, w przeciwieństwie do substancji nieorganicznych lub mineralnych, które były wykorzystywane przez ludzi do celów komercyjnych, eksperymentów lub do wykonywania określonych zadań domowych.
Historia chemii organicznej
Już przed 1828 r. dokonywano rozróżnienia między chemią organiczną a chemią nieorganiczną. Materia organiczna została powiązana ze stworzeniem poprzez "siła życiowa", a nieorganiczny z nieożywionym, z minerałem. Biorąc pod uwagę te koncepcje, nie można było oczekiwać, że w laboratorium uzyska się związki organiczne z materiałów nieorganicznych.
Jednak, w 1828 Friedrich Wöhler (1800-1882) udało się przygotować substancję organiczną, mocznik CO (NH2)2, ważny produkt metabolizmu zwierząt, ze związków nieorganicznych. Leczenie Cyjanian Ołowiu Pb (CNO)2 z Amoniak NH3 dostać Cyjanian amonu NH4CNO; Ten związek rzeczywiście powstał, ale gdy roztwór był gotowany w celu skrystalizowania cyjanianu amonu, został przekształcony w mocznik.
Ta zmiana chemiczna jest przykładem Przegrupowanie wewnętrzne, w którym liczba lub klasa atomów w cząsteczce nie zmienia się, a jedynie ich kolejność w jej obrębie. Tego typu przemiany są bardzo powszechne w chemii organicznej.
Odkrycie Wöhlera zapoczątkowało później porzucenie teorii siły życiowej całkowicie odrzucone, po czym następuje przygotowanie wielu innych związków organicznych w laboratorium. Mimo to kwalifikatory nieorganiczne i organiczne pozostają, ponieważ związki nieorganiczne są powiązane z produktami mineralnymi a związki organiczne, które w rzeczywistości są związkami węgla i wodoru oraz ich pochodnymi, są typu wytwarzanego przez żywe organizmy.
Chociaż prawa chemii ogólnej odnoszą się w równym stopniu do obu związków, różne przyczyny uzasadniają i sprawiają, że podział ten jest konieczny. Zatem związki organiczne i nieorganiczne różnią się między sobą różnymi właściwościami, takimi jak: ich Rozpuszczalność preferowany w rozpuszczalnikach organicznych (eter, alkohol, chloroform itp.) oraz odpowiednio w wodzie Stabilność (związki organiczne rozkładają się w stosunkowo niskich temperaturach), a Charakter reakcji; dla związków nieorganicznych są jonowe, proste i praktycznie natychmiastowe, a dla związków organicznych są kowalencyjne, złożone i powolne.
Związki organiczne
Znane są związki węgla o łańcuchach do dziewięćdziesięciu atomów. więzy Atomy węgla mogą być liniowy i rozgałęziony i mają pojedyncze wiązania kowalencyjne lub mają podwójne lub potrójne wiązania. Wiadomo, że ponad 2500 związków zawiera tylko węgiel i wodór (Węglowodory).
Izomeria związków organicznych
W związkach nieorganicznych wzór na ogół przedstawia pojedynczy związek; tak więc istnieje tylko jedna substancja o wzorze H formula2południowy zachód4. Cząsteczka Kwasu Siarkowego zawiera dwa atomy wodoru, jeden siarki i cztery tlenu, w specyficznym i niepowtarzalnym układzie. W związkach organicznych jest rzadko, żeby tak się stało. Na przykład istnieją dwa związki, które odpowiadają wzorowi C2H6Lub alkohol etylowy lub etanol i eter dimetylowy.

Im bardziej złożona cząsteczka, czyli im większa liczba atomów węgla, tym większa liczba możliwych izomerów.
Analiza związków organicznych
Analiza związku organicznego obejmuje: analiza jakościowa, analiza ilościowa i Analiza funkcjonalna. W przypadku przypuszczenia, że związek jest w stanie nieczystym, jest on wcześniej oczyszczany przez Krystalizacja, Destylacja, Sublimacja, Ekstrakcjaitp. Kryterium czystości można ocenić na podstawie jego stałych fizycznych, takich jak temperatura topnienia, temperatura wrzenia, gęstość, rozpuszczalność, postać krystaliczna, współczynnik załamania światła itp.
analiza jakościowa Weryfikuje się to poprzez badanie obecności pierwiastków tworzących związek, zwłaszcza węgla, wodoru i azotu, a czasami halogenów, siarki i fosforu.
analiza ilościowa Przeprowadza się ją, wykorzystując jako podstawę metody stosowane do analizy jakościowej. Punktem wyjścia jest określona ilość substancji, która ulega spaleniu, a dwutlenek węgla jest zbierany i ważony. węgiel i para wodna powstające w celu obliczenia procentowej zawartości węgla i wodoru w złożony. Wyniki analizy ilościowej ułatwiają obliczenie wzór empiryczny, chociaż wzór cząsteczkowy można znaleźć dopiero po określeniu masy cząsteczkowej substancji. Ale problem nie został jeszcze rozwiązany, ponieważ ten sam wzór cząsteczkowy może odpowiadać różnym izomerom.
Klasyfikacja związków organicznych
Zgodnie z ich budową związki organiczne dzielą się na związki alifatyczny, aromatyczny Tak heterocykliczny. Związki alifatyczne są powiązane z metanem CH4, są otwartymi łańcuchami, z wyjątkiem cykloparafin, a swoją nazwę zawdzięczają temu, że do tej grupy należą tłuszcze zwierzęce i roślinne.
związki aromatyczne, zamknięty łańcuch, blisko spokrewniony z benzenem, C6H6, a swoją nazwę zawdzięczają temu, że wiele z nich ma pachnące, przyjemne zapachy.
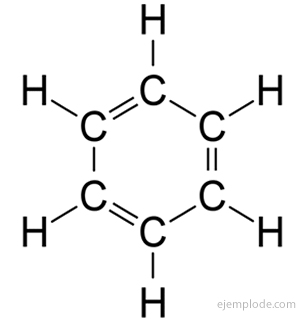
Pierścień benzenowy
związki heterocykliczne Są to związki o zamkniętym łańcuchu, w których w pierścieniu występuje pierwiastek inny niż węgiel.
Ze względu na swoją konstytucję są to:
Węglowodory, który z kolei ze względu na rodzaj posiadanych linków jest klasyfikowany jako Alkany, Alkeny Tak Alkiny. Ponadto do tej kategorii należą cykloalkany, benzen i ich pochodne składające się wyłącznie z węgla i wodoru.
Związki heterocykliczne
Pochodne chlorowcowane:R-X
Związki nitro:R-NIE2
Kwasy sulfonowe:R-SO3H
Nitryle (OR cyjanki alkilowe) i izonitryle:R-CN i R-NC. Różnią się one sposobem wiązania atomu azotu w cząsteczce.
Alkohole:R-OH
Fenole: Związki oparte na szkielecie składającym się z pierścienia benzenowego z dodaną grupą hydroksylową.

Etery:R-O-R
Merkaptany: R-SH
Tioetery:R-S-R
Tiokwasy:R-COSH
Aldehydy:R-CHO
Ketony:R-CO-R
Kwasy karboksylowe:R-COOH
Ty wyjdź:R-COOM (M jak metal)
Estry: R-COO-R
Bezwodniki: R-CO-O-OC-R
Aminy:R-NH2, R-NH-R, 2R-N-R
Węglowodany typu Aldosa:-CHOH-CHOH-CHO
Węglowodany typu ketozy:-CHOH-CO-CH2O
Związki metaloorganiczne:R-M-R
Halogenki metaloalkilowe:R-MX (znane również jako odczynniki Grignarda)
