Rodzaje wiązań chemicznych
Chemia / / July 04, 2021
Gdy dwa lub więcej atomów tworzy cząsteczkę, łączą się ze sobą za pomocą a złącze między elektronami z jego ostatnich warstw, najbardziej powierzchowna. Ten związek nazywa się Wiązanie chemiczne. Aby powstało wiązanie chemiczne, atomy muszą mieć swoje niekompletny oktet, czyli mniej niż osiem elektronów w ich ostatniej powłoce, co jest liczbą, która zapewni im stabilność chemiczną.
Istnieją trzy rodzaje wiązań chemicznych:
- Wiązania jonowe
- Wiązania kowalencyjne
- Metalowe linki
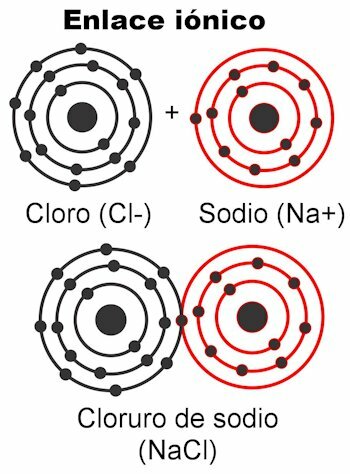
Wiązania jonowe
Wiązania jonowe to te, w których elektrony walencyjne są przyciągane przez siły elektrostatyczne. Atom(y), które mają od 1 do 4 elektronów walencyjnych, mogą dostarczyć je w celu utworzenia wiązania; Daje mu to ładunek dodatni, ponieważ pozbyłby się ładunków ujemnych. Z drugiej strony atom(y), które mają od 5 do 7 elektronów walencyjnych, będą w stanie otrzymać te niezbędne do osiągnięcia 8.
Daje im to ładunek ujemny, ponieważ wychwytują elektrony, które są ujemne. Fakt, że elektrony mogą być wychwycone lub dostarczone
nadaje atomom ładunek elektryczny. Zgodnie z prawem Coulomba ładunki powstałe na obu atomach będą przyciągać się nawzajem siłą, czyli elektrostatyka wspomniana powyżej. Ładunki ujemne przyciągają ładunki dodatnie i odwrotnie. Przeciwne ładunki przyciągają. Gdy ta siła zwiąże je razem, powstaje cząsteczka.Wiązania jonowe występują głównie między atomami metali i niemetali. Metale oddają swoje elektrony i zawsze przenoszą ładunek dodatni, uczestnicząc jako kation (+). Niemetale są receptorami elektronów i ogólnie przenoszą ładunek ujemny, uczestniczą jako aniony (-), ale zdarza się też, że niosą ładunek dodatni, gdy tworzą grupy naładowanych atomów nazywa radykałowie, jako amon NH4+, węglan CO3-2, fosforan PO4-3.
Wśród związków chemicznych, które tworzą wiązania jonowe, są:
- Sole binarne
- Oxisale
Gdy te substancje rozpuszczą się w wodzie dysocjująa mianowicie oddzielić na ich ładunki elektryczne i są one rozproszone w wodzie wraz z jonami wodorowymi H+ i hydroksyl (OH-), które tworzą wodę. Powstająca mieszanina to roztwór o nazwie elektrolit.
- Kontynuuj czytanie: Wiązanie jonowe
Wiązania kowalencyjne
Wiązania kowalencyjne to te, w których elektrony są wspólne bez odrywania ich od atomu, czyli bez tworzenia ładunków elektrycznych. Atomy są utrzymywane razem przez bliskość i wykorzystują siłę, z jaką jądro przyciąga elektrony. Po utworzeniu wiązania co najmniej dwa jądra atomów przyciągają wspólne elektrony, spełniając w ten sposób zasadę oktetu i czyniąc cząsteczkę stabilną.
Istnieje kilka form wiązania kowalencyjnego, a są to:
- Wiązanie kowalencyjne
- Współrzędne wiązanie kowalencyjne
- Polarne wiązanie kowalencyjne
- Niepolarne wiązanie kowalencyjne
wiązanie kowalencyjne Jest dokładnie taki sam jak ten opisany na początku. Uczestniczące atomy dzielą elektrony, tak że wszystkie mają swój pełny oktet. Nie ma tu żadnych ładunków elektrycznych, ponieważ elektrony nie są zrzucane, są po prostu dzielone.
w koordynować wiązanie kowalencyjne tylko jeden atom dostarcza wszystkie elektrony potrzebne do wiązania. Drugi atom po prostu wiąże się ze sobą i bierze te elektrony za swoje. W ten sposób powstaje cząsteczka. Tak jest na przykład w przypadku kwasu siarkowego H2południowy zachód4 w którym siarka dzieli dwie pary elektronów z atomami tlenu.
w polarne wiązanie kowalencyjne, siły między atomami są przechylone na jedną stronę cząsteczki. To kiedy istnieją różne rodzaje atomów w cząsteczce. Siła ta jest mierzona w jednostkach Debye'a, a im większa jest jej wartość po jednej stronie cząsteczki, tym bardziej będzie polarna. Oznacza to, że w konstrukcji uformowane są słupy i dlatego nadano im taką nazwę. Jego siły są asymetryczne.
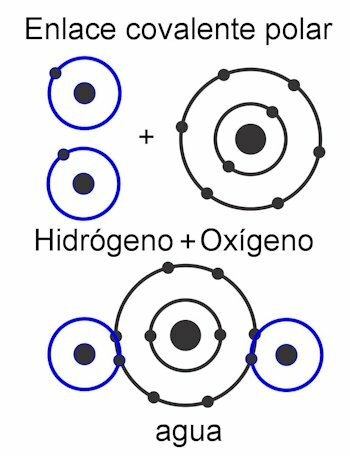
w niepolarne wiązanie kowalencyjne, siły między atomami są równomierne w całej cząsteczce, a zatem w jej strukturze nie tworzą się bieguny. Pracuje jako pojedyncza jednostka i dlatego bardzo trudno, prawie niemożliwie, podzielić jej ładunki. To sprawia, że jest nierozpuszczalny w wodzie. Tak jest w przypadku związków takich jak alkany, które mają równe siły w całej cząsteczce. Jego siły są symetryczne.

- Kontynuuj czytanie: Wiązanie kowalencyjne
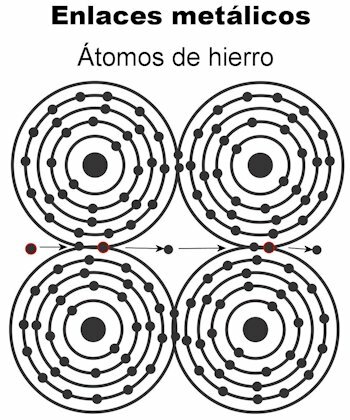
Wiązanie metaliczne
Atomy metalu są utrzymywane razem za pomocą wiązań metalicznych. W tego typu wiązaniu elektrony wszystkich atomów są przyciągane, tworząc sieć krystaliczną, która pozostaje sztywna. Wiązania sieci krystalicznej mają wszystkie elektrony przeplatane i przystosowane do przewodzenia prądu elektrycznego i ciepła kiedy zostanie im przekazany. W metalach przejściowych ta struktura wiązań metalicznych jest bardziej godna uwagi, ponieważ ich atomy są większe.
Przykłady wiązania jonowego
Niektóre substancje, które mają wiązania jonowe to:
- chlorek sodu NaCl. Jego jony to Na+ i Cl-.
- Chlorek potasu KCl. Jego jony to K+ i Cl-.
- Chlorek wapnia CaCl2. Jego jony to Ca+2 i Cl-.
- Chlorek magnezu MgCl2. Jego jony to Mg+2 i Cl-.
- chlorek strontu SrCl2. Jego jony to Sr+2 i Cl-.
- Chlorek Baru BaCl2. Jego jony to Ba+2 i Cl-.
- chlorek glinu AlCl3. Jego jony to Al+3 i Cl-.
- Siarczan sodu2południowy zachód4. Jego jony to Na+ A więc4-2.
- Siarczan potasu K2południowy zachód4. Jego jony to K+ A więc4-2.
- Siarczan wapnia CaSO4. Jego jony to Ca+2 A więc4-2.
- Siarczan Wapnia MgSO4. Jego jony to Mg+2 A więc4-2.
- Siarczan Strontu SrSO4. Jego jony to Sr+2 A więc4-2.
- Siarczan Baru BaSO4. Jego jony to Ba+2 A więc4-2.
- Fosforan sodu3PO4. Jego jony to Na+ i PO4-3.
- Fosforan potasu K3PO4. Jego jony to K+ i PO4-3.
- Fosforan Magnezu Mg3(PO4)2. Jego jony to Mg+2 i PO4-3.
- Fosforan wapnia Ca3(PO4)2. Jego jony to Ca+2 i PO4-3.
- Fosforan glinu AlPO4. Jego jony to Al+3 i PO4-3.
- Fosforan żelazawy Fe3(PO4)2. Jego jony to Fe+2 i PO4-3.
- Fosforan żelazowy FePO4. Jego jony to Fe+3 i PO4-3.
Przykłady wiązania kowalencyjnego
Niektóre substancje, które zawierają wiązania kowalencyjne to:
- Metan CH4.
- Etan C2H6.
- Propan C3H8.
- Butan C4H10.
- Pentan C5H12.
- Heksan C6H14.
- Heptan C7H16.
- Oktan C8H18.
- Propylen CH2= CH2–CH3.
- Acetylen C2H2.
- Alkohol metylowy CH3
- Alkohol etylowy C2H5
- Alkohol propylowy C3H7
- Alkohol izopropylowy CH3CH(OH) CH3.
- 2-propanon lub aceton CH3Samochód3.
- Formaldehyd HCHO.
- Aldehyd octowy CH3
- Aldehyd propionowy CH3CH2
- Aldehyd masłowy CH3CH2CH2
- Kwas mrówkowy HCOOH.
Przykłady wiązania metalicznego
Niektóre substancje zawierające wiązanie metaliczne to:
- Cynk Zn
- Kadm Cd
- Miedź Cu
- Srebrny Ag
- Złoty Au
- Nikiel Ni
- Pallad Pd
- Platynowa Pt
- Kobalt Co
- Rod Rh
- Iryd Go
- Żelazo Fe
- Ruten Ru
- Osm Os
- Mangan Mn
- chrom Cr
- Molibden Mo
- Wolfram W
- Wanad V
- Cyrkon Zr
Postępuj zgodnie z:
- Atomy
- Jon
- Metale
- Brak metali
- Alkany
- Rozwiązania



