Przykład gazu doskonałego i rzeczywistego
Fizyka / / July 04, 2021
ZA Gaz doskonały to ten, którego właściwości takie jak Pokrycie ciśnienia, temperatury i objętości, oni trzymają zawsze proporcja lub stały związek między nimi. Innymi słowy, jego zachowanie jest zgodne z prawem gazu doskonałego, które przedstawia się następująco:
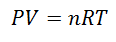
Aby dojść do tej formuły, zaczynamy od La Prawo ogólne państwa gazowego, który opisuje, że istnieje stały związek między właściwościami gazu przez cały czas trwania procesu. Właściwości, o których mowa, to are Nacisk w układzie, w którym znajduje się gaz, Tom który zajmuje gaz, a Temperatura gazu.
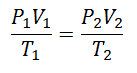
Zdecydowano prędzej czy później stworzyć prostsze wyrażenie, nadając stałości literę towarzyszącą wyrażeniu:
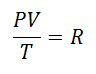
To się nazywało Uniwersalna stała gazowa przy współczynniku R, a jego wartość jest następująca:
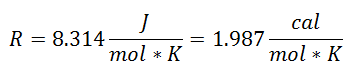
A ponieważ uniwersalna stała gazowa ma zastosowanie do każdego mola gazu, Liczba moli gazu jako jeszcze jeden czynnik, aby objąć całą substancję obecną w systemie podczas procesu. Ostateczne równanie będziemy już mieli w tej postaci:
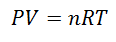
Powyższe równanie to
Prawo dotyczące gazu doskonałegoi dotyczy gazów o temperaturze od umiarkowanej do wysokiej. W ten sposób każdą ze zmiennych można obliczyć, po określeniu pozostałych.Różnica między gazami idealnymi a rzeczywistymi Real
To prawo dotyczące gazu doskonałego nie dotyczy dla gazów, które są w niskie temperatury lub blisko punktu, w którym stają się płynne.
Niskie temperatury powodują a mniejszy ruch cząstek gaz, a te opadną bardziej, zajmując inną objętość niż wtedy, gdy zostały całkowicie rozproszone.
Ponadto z tego samego powodu ćwiczyliby Nierówne ciśnienie w całym systemie. Proporcjonalność zacznie zawodzić, a formuła nie będzie miała takiej samej ważności dla obliczeń.
W takim przypadku należy zastosować równania dla gazów rzeczywistych.
ZA Prawdziwy gaz to ten, którego właściwości nie przestrzegają dokładnie w odniesieniu do siebie jak w Prawie Gazu Idealnego, a więc sposób obliczania tych właściwości jest modyfikowany.
Równania stanu dla gazów rzeczywistych
1.- Równanie wirusowe:
Dla gazu, który pozostaje na Stała temperatura, związek między ciśnieniem a objętością lub ciśnieniem a objętością właściwą (objętość zajmowana przez każdą jednostkę masy gazu).
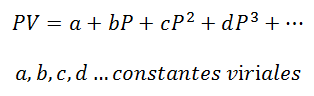
Stałe wirialne są charakterystyką każdego gazu, z określonymi wartościami, które zależą od temperatury.
Można wykonać tylko obliczenia ciśnienia i objętości; Temperatura jest wcześniej określana poprzez obserwację procesu. W przypadku tych obliczeń zmienne równania wirialnego są wyczyszczone:
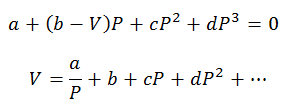
Stałe wirialne do rozwiązywania równań są uzyskiwane z wyspecjalizowanych tabel.
2.- RównanieVan der Waalsa na:
Równanie Van der Waalsa to kolejne wyrażenie używane do obliczania właściwości gazu rzeczywistego i podobnie jak równanie wirialne wymaga również jego stałych:

Stałe są również sprawdzane w tabelach.
3.- RównanieCzerwony Lewch-Kwong:
To równanie bardzo dobrze sprawdza się przy wykonywaniu obliczeń z gazami w niemal każdej temperaturze i średnim ciśnieniu, ale nie za wysokim, na przykład w setkach atmosfer.
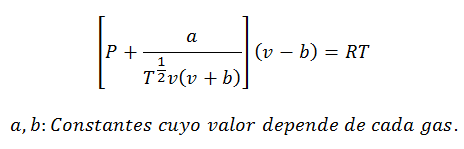
Stałe są również sprawdzane w tabelach.
Możesz wyczyścić ciśnienie, temperaturę i objętość, aby wykonać obliczenia. Odprawy pozostają:
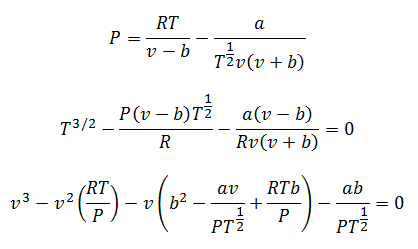
4.-Równanie Berthelota:
Za pomocą tego równania można obliczyć dowolną ze zmiennych. Tylko ma dwa różne tryby: dla niskich ciśnień i dla wysokich ciśnień.
Dla niskich ciśnień:

Dla wysokich ciśnień:
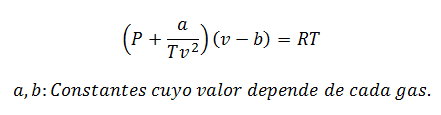
Stałe są również sprawdzane w tabelach.
5.-Równanie współczynnika ściśliwości
To równanie jest prostszym wariantem prawa gazu doskonałego; dodawany jest tylko współczynnik „z”, zwany współczynnikiem ściśliwości. Współczynnik ten uzyskuje się z ogólnego wykresu współczynnika ściśliwości, w zależności od temperatury, ciśnienia lub określonej objętości, w zależności od tego, co jest dostępne.
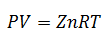
Przykłady gazów doskonałych i rzeczywistych
Jako idealna lub prawdziwa postać Zależy to od warunków ciśnienia, temperatury, w której znajduje się gaz, Nie ma możliwości ustalenia ograniczonej listy, dlatego przedstawiono listę gazów, które oczywiście można znaleźć w idealności i rzeczywistości.
- Amoniak
- Czynnik chłodniczy R134 (Etan DiFluoroDiCloro)
- Dwutlenek węgla
- Tlenek węgla
- Tlen
- Azot
- Wodór
- Dwutlenek azotu
- Trójtlenek diazotu
- pięciotlenek diazotu
- Heptoksyd dwuazotu
- Dwutlenek siarki
- Trójtlenek siarki
- Chlor
- Hel
- Neon
- Argon
- Krypton
- Ksenon
- Metan
- Etan
- Propan
- Butan

