Definicja prawa okresowego
Różne / / July 04, 2021
Florencia Ucha, lip. 2012
 prawo okresowy czy on jest fundacja układ okresowy pierwiastków żywiołów, jak schemat uniwersalny, który porządkuje, klasyfikuje i dystrybuuje różne istniejące pierwiastki chemiczne w zależności od ich cech i właściwości.
prawo okresowy czy on jest fundacja układ okresowy pierwiastków żywiołów, jak schemat uniwersalny, który porządkuje, klasyfikuje i dystrybuuje różne istniejące pierwiastki chemiczne w zależności od ich cech i właściwości.
Podstawa, na której opiera się układ okresowy pierwiastków
Tymczasem prawo okresowe stanowi, że właściwości fizykochemiczne wymienionych pierwiastków są skłonni do systematycznego powtarzania wraz ze wzrostem liczby atomowej pierwiastków.
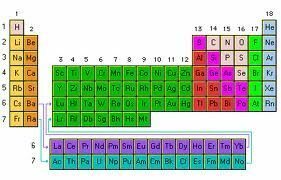
Układ okresowy pierwiastków: organizacja pierwiastków chemicznych w porządku rosnącym zgodnie z liczbą atomów, które ma każdy z nich
Tak słynna tabela elementów, którą badamy w szkołaW przedmiotach fizyki i chemii jest to schemat, który zajmuje się porządkowaniem pierwiastków chemicznych zgodnie z ich rosnącym porządkiem pod względem liczby atomów.
Pionowe kolumny tabeli nazywane są grupami i zawierają elementy o tej samej wartościowości atomowej, a zatem mają podobne właściwości, natomiast w poziomych rzędach, zwanych okresami, zgrupowane są elementy o różnych właściwościach, ale o podobnych masach.
Jak ta wiedza została zaawansowana: konkretne i stopniowe wydarzenia
Należy zauważyć, że wszystkie te koncepcje nieodłącznie związane z fizyką i chemią były rozwijane stopniowo i stopniowo w XIX wieku.
Trzeba powiedzieć, że niektóre pierwiastki, takie jak srebro (Ag), złoto (Au), miedź (Cu), ołów (Pb) i rtęć (Hg), już od starożytności posiadały doskonałą wiedzę, pierwsze naukowe odkrycie pierwiastka miało miejsce w XVII wieku, kiedy alchemik Henning Brand po raz pierwszy zidentyfikował pierwiastek fosfor (P).
W następnym stuleciu, czyli w wieku XVIII, zaczęto poznawać nowe elementy, z których najistotniejszym jest being gazy, dzięki rozwojowi chemii pneumatyki, w tym tlenu (O), azotu (N) i wodoru (H).
Mniej więcej w tym czasie francuski chemik Antoine Lavoisier napisał listę prostych substancji, w których pojawiły się już 33 pierwiastki.
Na początku XIX wieku wynalezienie baterii elektrycznej zapoczątkowało badania zjawisk chemicznych nowy, a to doprowadziło do odkrycia większej liczby pierwiastków, takich jak metale alkaliczne i ziem alkalicznych.
Do 1830 roku zidentyfikowano już 55 pierwiastków.
W połowie XIX wieku, wraz z wynalezieniem urządzenia zwanego spektroskopem, znaleziono więcej elementów, zwłaszcza te związane z kolorem, który przedstawiał ich linie spektralne, w tym cez, tal i rubid, dla wymienić kilka.
Spektroskop jest instrumentem służącym do obserwacji i osiągania widmo, ponieważ jest to wynikiem rozproszenia serii promieniowania, dźwięków lub zjawisk falowych.
Podobieństwo, jakie pewne pierwiastki przedstawione pod względem właściwości chemicznych i fizycznych doprowadziło do pewnych ówcześni naukowcy postanowili uporządkować je systematycznie, pogrupować według pewnych kryteria.
poprzednik Najbardziej odległa od obowiązującego prawa jest to, co nam się wydaje. Prawo oktaw, opracowane przez angielskiego chemika Johna Alexandra Newlands, który zaproponował przebudzenie wielką nowością, że co osiem elementów znajdujemy się przed podobnymi właściwościami.
Był to dla niego początek do sformułowania własnego układu okresowego pierwiastków, formalnie opublikowanego w 1863 roku.
Jakbyś był w wyścigi postów rękawiczka w tym sensie została podjęta przez innego chemika, w tym przypadku Niemiec Julius Lothar Meyer, który na podstawie wyników Newlandsa w roku 1870 określił objętości atomowe pierwiastków.
Kiedy już obliczył masy atomowe i wykreślił je, był w stanie zademonstrować światu nauka potwierdza, że masa atomowa implikuje wzrost właściwości fizyczny.
I niemal równocześnie z dziełami Meyera, Urodzony w Rosji chemik Dimitri Mendelejew opublikuj pierwszy układ okresowy, pokonując Meyera, który zrobiłby to rok później i dlatego jest tym, który pozostał z uznaniem jako jego twórca.
Mendelejew posortuje elementy w kolejności rosnącej na podstawie masa atomowa co oni prezentująW międzyczasie umieścił w tej samej rubryce tych, którzy mieli wspólne cechy.
Warto wspomnieć, że do tego czasu znane były już 63 elementy z 90 istniejących.
Tablica została uzupełniona pod koniec XIX wieku o kolejną grupę, zwaną zerową, składającą się z gazów szlachetnych.
Tematy w prawie okresowym