Como os ácidos, bases e sais são formados?
Miscelânea / / July 04, 2021
Existem várias teorias para definir o ácidos e as bases, entre os quais estão o Arrhenius, o Brönsted-Lowry e o Lewis.
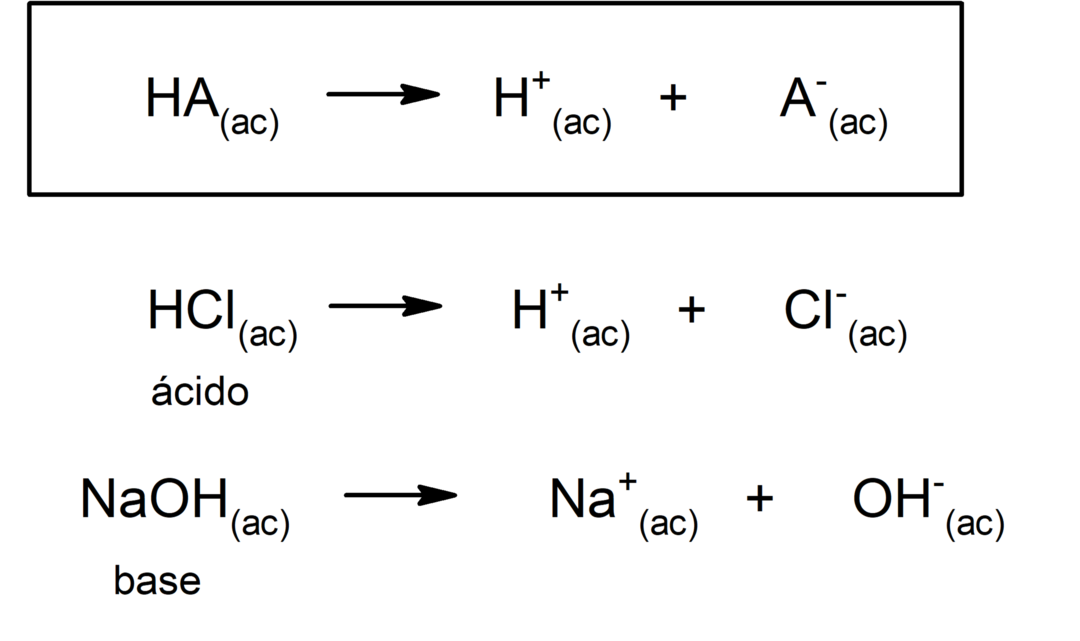
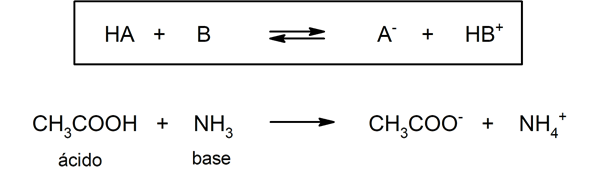
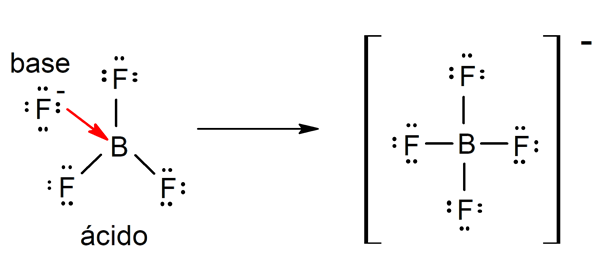
Ácidos de tipo oxácidos são geralmente formados por reação entre um óxido não metálico com água, enquanto ácidos do tipo hidrácidos são formados pela combinação de um metalóide com hidrogênio em solução aquosa. Por exemplo:ácido sulfúrico (H2SW4) é um oxácido e ácido clorídrico (HCl(ac)) é um hidrácido.
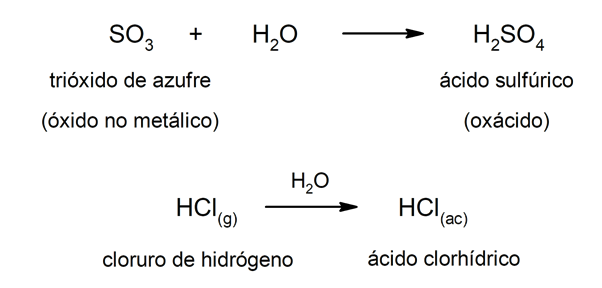
Por outro lado, as bases podem ser formadas como resultado da reação entre um óxido metálico E a água. Por exemplo: hidróxido de magnésio (Mg (OH)2).
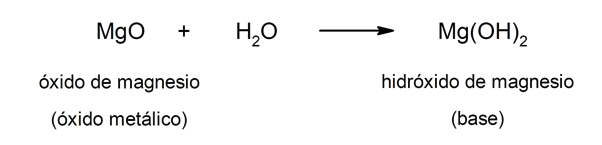
Características gerais de ácidos e bases
Em geral, os ácidos são azedo e corrosivo. As bases também são corrosivo, de sabor amargo, cáustico quando em contato com a pele e com toque de sabão. Por outro lado, as soluções ácidas têm um pH menor que 7, enquanto as soluções básicas têm um pH maior que 7.
Força de ácido e base
O tendência de um ácido dissociar e baixar o pH é frequentemente referido como "força do ácido". Um ácido é forte quando pode se dissociar completamente em solução aquosa e fraco quando sua dissociação ocorre parcialmente. Exemplos de ácidos fortes são perclórico (HClO
4), sulfúrico (H2SW4), iodídrico (HI), bromídrico (HBr), clorídrico (HCl) e nítrico (HNO3). Por outro lado, o ácido acético (CH3COOH), cítrico (C6H8OU7) e benzóico (C6H5COOH) são fracos.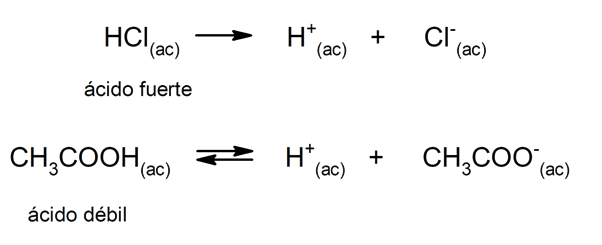
Da mesma forma, eles podem ser considerados como bases fortes aqueles que se dissociam completamente em solução aquosa, e enfraquecem quando sua dissociação ocorre parcialmente. Exemplos de bases fortes são hidróxido de potássio (KOH), sódio (NaOH), lítio (LiOH) e magnésio (Mg (OH)2). Por outro lado, amônia (NH3) é uma base fraca.
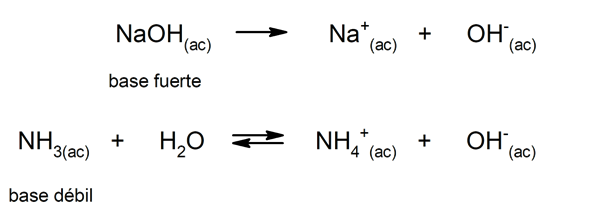
Como os sais são formados?
As você sai são compostos iônicos de complexidade variável, abundantes na natureza e geralmente formados pela combinação de ácidos com bases em uma reação de neutralização, que gera uma liberação de Água. Eles também podem ser formados como resultado da reação entre um metal e um ácido, de um metal e um não-metal, ou da reação entre diferentes sais.
Os sais podem ser classificados em:
Distribuição e importância
Os ácidos são extremamente importantes tanto em indústria como no natureza. Por exemplo, o ácido clorídrico faz parte do nosso sistema digestivo e é necessário para degradar os compostos nutricionais presentes na Comida. O ácido desoxirribonucléico, mais conhecido como DNA, compõe os cromossomos, que é onde se codifica a informação genética necessária para sua codificação. seres vivos multiplicar e desenvolver. O ácido bórico é um componente importante na indústria do vidro.
O carbonato de cálcio É um sal muito abundante em vários tipos de rochas calcárias. Por alta parcela temperaturas (900 ° C) a partir de carbonato de cálcio, óxido de cálcio ou cal viva. Adicionar água à cal viva produz hidróxido de cálcio, chamado cal apagada, que é uma base. Esses materiais eles são usados na construção.
Siga com:



