20 Exemplos de sais ácidos
Miscelânea / / July 04, 2021
No química Inorgânica sais são chamados de compostos que são obtidos quando um ácido seus átomos de hidrogênio são substituídos por cátions metálicos (embora às vezes por cátions não metálicos, por exemplo, o cátion de amônio, NH4+). No caso específico de sais de ácido, os hidrogênios do ácido são parcialmente substituídos, ou seja, pelo menos um hidrogênio não substituído permanece como parte do sal. Por serem distintos de sais neutros, onde os hidrogênios do ácido são totalmente substituídos.
As você sai são geralmente formados através da reação entre um ácido e um hidróxido (base). Nessas reações, normalmente a base perde seus grupos hidroxila (-OH) e o ácido os perde. átomos hidrogênio (H), formando um sal neutro; mas se o ácido em questão conservar pelo menos um de seus átomos de hidrogênio, alterando a carga elétrica da reação, obteremos um sal ácido ou um sal hidrogenado.
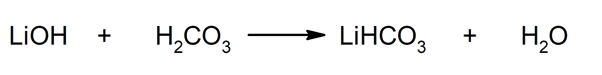
Assim, por exemplo, bicarbonato de lítio e água são obtidos a partir da reação entre hidróxido de lítio e ácido carbônico:
Nomenclatura de sais de ácido
Os sais de ácido podem ser nomeados de acordo com três tipos nomenclatura mais comum:
Exemplos de sais ácidos
- Bicarbonato de Sódio (NaHCO3). Também chamado de hidrogenocarbonato de sódio (IV), é um sólido cristalino branco, solúvel em água, que pode ser encontrado na natureza no estado. mineral ou pode ser produzido em laboratório. É um dos sais de ácido mais conhecidos e é amplamente utilizado em confeitaria, farmacologia ou fabricação de iogurte.
- Bicarbonato de lítio (LiHCO3). Este sal ácido tem sido usado como agente de captura de CO2 em situações em que esse gás é indesejável, como nas missões espaciais norte-americanas "Apollo".
- Dihidrogenofosfato de potássio (KH2PO4). É um sólido cristalino, inodoro, solúvel em água, amplamente utilizado em diversos setores como levedura de Comida, agente quelante, fortificante nutricional e auxiliar nos processos fermentativos.
- Bissulfato de sódio (NaHSO4). É um sal ácido formado pela neutralização do ácido sulfúrico. É amplamente utilizado industrialmente no refino de metais e produtos de limpeza. Embora seja altamente tóxico para alguns equinodermos, é usado como aditivo em alimentos para animais de estimação e na fabricação de joias.
- Sulfeto de hidrogênio de sódio (NaHS). É um composto perigoso de manusear, pois é altamente corrosivo e tóxico. Pode causar queimaduras na pele e lesões oculares graves, uma vez que também é combustível.
- Hidrogenofosfato de cálcio (CaHPO4). É usado como suplemento dietético em cereais para gado. É um sólido insolúvel em água, mas capaz de cristalizar quando hidratado ao consumir dois moléculas de água.
- Hidrogenocarbonato de amônio ([NH4] HCO3). Também conhecido como "bicarbonato de amônio", é utilizado na indústria alimentícia como levedura químico, embora tenha a desvantagem de reter amônia e dar aos alimentos um gosto ruim se usado em excesso. Ele também é usado em extintores de incêndio, fabricação de pigmentos e para expandir borracha.
- Bicarbonato de bariou (Ba [HCO3]2). É um sal ácido que quando aquecido pode reverter sua reação de produção e é altamente instável, exceto em solução. É amplamente utilizado na indústria cerâmica.
- Bissulfito de sódio (NaHSO3). Este sal é extremamente instável e na presença de oxigênio ele se transforma em sulfato de sódio (Na2SW4), por isso é usado na indústria de alimentos como conservante e dessecante de alimentos. É um redutor extremo e muito utilizado pelo homem, também utilizado na fixação de cores.
- Citrato de cálcio (AC3[C6H5OU7]2). Vulgarmente conhecido como sal amargo, é utilizado como conservante alimentar e como suplemento nutricional quando está ligado ao aminoácido lisina. É um pó cristalino, branco e inodoro.
- Fosfato monocálcico (Ca [H2PO4]2). É um sólido incolor obtido a partir da reação do hidróxido de cálcio com o ácido fosfórico, muito utilizado como fermento ou como fertilizante em trabalhos agrícolas.
- Fosfato dicálcico (CaHPO4). Também conhecido como mono-hidrogenofosfato de cálcio, possui três formas cristalinas diferentes que são utilizadas como aditivo em alimentos e está presente em dentifrícios. Além disso, é naturalmente formado em cálculos renais e na chamada “pedra nos rins”.
- Fosfato de Monomagnésio (MgH4P2OU8). É um sal branco, cristalino e inodoro, parcialmente solúvel em água. É utilizado na preservação de alimentos, como acidulante, corretivo de acidez ou agente no tratamento de farinhas.
- Diacetato de sódio (NaH [C2H3OU2]2). Este sal é utilizado como aromatizante e conservante nas refeições, o que previne ou retarda o aparecimento de cogumelos e micobactérias, tanto em produtos embalados a vácuo, como produtos cárneos, quanto na indústria de farinhas.
- Bicarbonato de cálcio (Ca [HCO3]2). É um sal hidrogenado originado do carbonato de cálcio, presente em minerais como calcário, mármore e outros. Esta reação envolve a presença de água e CO2, por isso pode ocorrer espontaneamente em cavernas e cavernas ricas em cálcio.
- Fluoreto de ácido rubídio (RbHF). Este sal é obtido a partir da reação entre o ácido fluorídrico (hidrogênio e flúor) e o rubídio, um metal alcalino. O resultado é um composto tóxico e corrosivo que deve ser manuseado com cuidado.
- Fosfato de monoamônio ([NH4] H2PO4). É um sal solúvel em água produzido pela reação da amônia com o ácido fosfórico. Geralmente é usado como fertilizante, pois dá ao solo a nutrientes de nitrogênio e fósforo necessários para o crescimento da planta. Também faz parte do pó ABC em extintores de incêndio.
- Hidrogenorortoborato de zinco (Zn [HBO3]). É um sal utilizado como anti-séptico e como aditivo na fabricação de cerâmicas.
- Fosfato monossódico (NaH2PO4). É usado principalmente em laboratórios, como um "tampão" ou solução tampão, o que evita mudanças bruscas no pH de uma solução.
- Hidrogenoftalato de potássio (KHP). Também chamado de "ftalato de ácido de potássio", é um sal sólido e estável no ar comum, razão pela qual é frequentemente usado como um padrão primário em medições de pH. Também é útil como um agente de buffer em reações químicas.
Siga com:
