20 Exemplos de Alcanos
Miscelânea / / July 04, 2021
O alcanos eles são uma espécie de hidrocarbonetos em que um número variável de átomos de carbono são unidos por ligações simples, como um esqueleto, e cada átomo de carbono está ligado, por sua vez, a átomos de hidrogênio, que podem eventualmente ser substituídos por outros átomos ou grupos funcionais. Por exemplo: clorofórmio, metano, octano.
O Fórmula molecular dos alcanos de cadeia linear aberta é CnH2n + 2, onde C representa carbono, H representa hidrogênio e n representa o número de átomos de carbono. Alcanos são hidrocarbonetos saturados, o que significa que não possuem ligações duplas ou triplas. Para nomeá-los, você usa o sufixo "-Ano" após nomear a cadeia de carbono usando o prefixo correspondendo ao número de átomos de carbono (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7), etc).
Pode servir a você:
Classificação de alcanos
Dentro dos alcanos, eles são geralmente reconhecidos dois grandes grupos: cadeia aberta (também chamada acíclica) e cadeia fechada (ou cíclica).
Quando o
compostos de cadeia aberta Não apresentam nenhuma substituição dos hidrogênios que acompanham cada átomo de carbono, são chamados de alcanos lineares: são os alcanos mais simples. Quando apresentam a substituição de algum de seus hidrogênios por uma ou mais cadeias de carbono, são chamados de alcanos ramificados. Os substituintes mais comuns são os grupos etil (CH3CH2-) e metil (CH3-).Por sua vez, há compostos com um único ciclo na molécula (monocíclicos) e outros com vários (policíclicos). O alcanos cíclicos podem ser homocíclicos (são formados com a intervenção exclusiva de átomos de carbono) ou heterocíclicos (dos quais participam outros átomos, por exemplo, oxigênio ou enxofre).
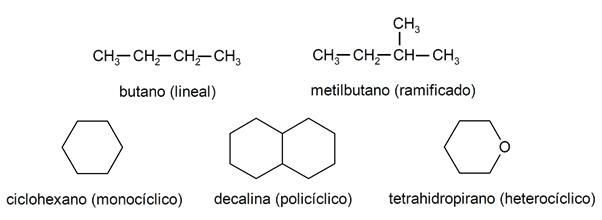
Propriedades físicas de alcanos
Em geral, propriedades físicas de alcanos são condicionados pela massa molecular (por sua vez, ligada ao comprimento da cadeia de carbono). Aqueles com o menor número de carbonos são gasoso para temperatura ambiente, aqueles que variam de 5 a 18 átomos de carbono são líquidos, e acima deste número estão sólido (semelhante à cera).
Por serem menos densos que a água, eles tendem a flutuar sobre ela. Em geral, os alcanos são insolúveis em água e solúveis em solventes orgânicos.
O ponto de ebulição e de fusão de alcanos depende de sua massa molecular, isto é, do comprimento da cadeia de carbono, embora também dependam muitas vezes do arranjo espacial dos átomos. Os alcanos lineares e cíclicos têm pontos de ebulição mais altos do que os ramificados.
Propriedades químicas de alcanos
Alcanos são caracterizados por serem compostos químicos de muito fraca reatividade, é por isso que eles também são conhecidos como "parafinas" (em latim, parum affinis significa "baixa afinidade"). Eles são compostos que têm uma energia de ativação muito alta quando estão envolvidos em reações químicas. A reação mais importante que os alcanos podem sofrer é combustão gerando, na presença de oxigênio, calor, dióxido de carbono e água.
Alcanos são a base para uma importante variedade de reações associadas com processos industriais muito importante, sendo os combustíveis mais tradicionais. Eles também aparecem como produtos finais de processos biológicos, como a fermentação metanogênica realizada por alguns microorganismos.
Exemplos de alcanos
Alguns exemplos de alcanos (incluindo alguns bem conhecidos lineares e ramificados) são:
- Clorofórmio (nome fantasia do triclorometano; CHCl3). Vapores desta substância costumavam ser usados como anestésicos. Foi descontinuado para este fim porque foi descoberto que ele danificava órgãos importantes, como o fígado ou os rins. Seu uso hoje é principalmente como solvente ou refrigerante.
- Metano (CH4). É o alcano mais simples de todos: é composto de apenas um átomo de carbono e quatro átomos de hidrogênio. É um gás que ocorre naturalmente pela decomposição de diferentes substratos orgânicos e é o principal componente do gás natural. Nos últimos tempos, tem sido reconhecido como um dos gases que mais contribui para o chamado efeito estufa.
- Octano (C8H18). É o alcano de oito carbonos e é de grande importância, pois determina a qualidade final da nafta, que é um misturar de vários hidrocarbonetos. Essa qualidade é medida pela octanagem ou número de octanas do combustível, que toma como referência um de baixa detonação (índice 100) e outro de alta detonação (índice 0).
- Hexano (C6H14). É um solvente importante, sua inalação deve ser evitada por ser muito tóxico.
- Butano (C4H10). Junto com o propano (C3H8), constituem os chamados gases liquefeitos de petróleo (GLP), que se formam nas bolsas de gás durante o processo de extração do petróleo. Atualmente, a substituição da gasolina ou do óleo diesel pelo GLP como combustível está sendo promovida, uma vez que é de um hidrocarboneto mais ecológico (ele emite apenas dióxido de carbono e água em sua combustão).
- Icosano (C20H42). É o alcano de vinte carbonos (o prefixo 'ico' significa vinte)
- Ciclopropano (C3H6). Anteriormente, era usado como anestésico
- n-heptano (C7H16). É aquele que é tomado como referência para o ponto zero da escala de octanas da gasolina, que seria o menos desejável, pois queima de forma explosiva. É obtido a partir da resina de certos plantas.
- 3-etil-2,3-dimetilpentano (C9H20)
- 2-metilbutano (C5H12)
- 3-cloro-4-n-propilheptano (C10H21Cl)
- 3,4,6-trimetilheptano (C10H22)
- 1-bromo-2-feniletano (C8H9Br)
- 3-etil-4-metilhexano (C9H18)
- 5-isopropil-3-metilnonano (C13H28)
- cubano (C8H8)
- 1-bromopropano (C3H7Br)
- 3-metil-5-n-propiloctano (C12H26)
- 5-n-butil-4,7-dietildecano (C18H28)
- 3,3-dimetildecano (C12H26)