100 exemplos de elementos químicos
Miscelânea / / November 13, 2021
o elementos químicos são um tipo de assunto que por nenhum procedimento ou reação química eles podem ser reduzidos ou decompostos em outros elementos mais simples. Por isso, pode-se dizer que um elemento é tudo matéria feito por átomos da mesma e única classe, ou seja, átomos que possuem o mesmo número atômico (igual número de prótons), embora tenham massa atômica diferente. Por exemplo: enxofre, boro, cromo, estanho.
A primeira definição de um elemento químico foi introduzida por Lavoisier no Traite Élémentaire de Chimie, em 1789. No século 18, Lavoisier subdividiu substâncias simples em quatro grupos:
Tabela Periódica dos Elementos
Hoje eles se conhecem 118 elementos químicos. Eles são todos reunidos, classificados e organizados de acordo com muitas de suas propriedades em um esquema gráfico conhecido como Tabela Periódica dos Elementos, que foi originalmente criada pelo químico russo Dimitri Mendeleyev em 1869. A Tabela Periódica é composta por 18 grupos (colunas) e 7 períodos (linhas), nos quais estão localizados os elementos químicos.
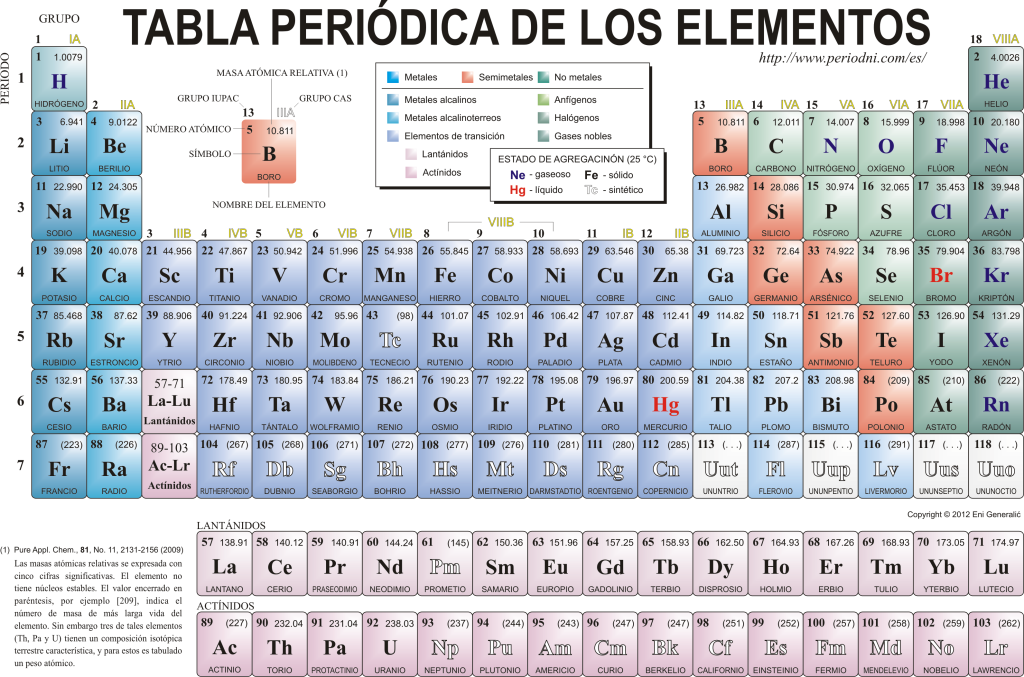
o grupos principais que podem ser encontrados nesta tabela são:
Os metais alcalinos (Grupo 1), os metais alcalino-terrosos (Grupo 2), a família do escândio, que inclui os terrosos e os actinídeos (Grupo 3), a família do titânio (Grupo 4), a família do vanádio (Grupo 5), a família do cromo (Grupo 6), a família do manganês (Grupo 7), a família do ferro (Grupo 8), a família do cobalto (Grupo 9), a família do níquel (Grupo 10), a família do cobre (Grupo 11), a família do zinco (Grupo 12), elementos terra (Grupo 13), elementos carbonetos, neste grupo é Carbono, que constitui a base da vida na Terra (Grupo 14), elementos formadores de nitrogênio (Grupo 15), elementos anfigenéticos, inclui o oxigênio, um elemento fundamental para a respirando dos seres vivos (Grupo 16), elementos halógenos (Grupo 17) e gases nobres (Grupo 18).
Muitos desses elementos têm isótopos estáveis ou radioativos, ou seja, o mesmo elemento químico, por exemplo, hidrogênio (H), pode ter vários isótopos (1H, 2H, 3H). Isso significa que cada átomo de isótopo tem o mesmo número de prótons (o que implica que pertence ao mesmo elemento químico) e um número diferente de nêutrons.
Alguns isótopos não são estáveis (radioativos), ou seja, desintegrar em um determinado tempo, emitindo certas partículas (nêutrons, fótons, partículas alfa, entre outros) e gerando outros isótopos estáveis ou radioativos. Os elementos químicos têm propriedades como o ponto de ebulição e aquele de fusão, eletro-negatividade, densidade e raio iônico, entre outros. Essas propriedades são importantes porque nos permitem prever seu comportamento, reatividade, etc.
Como os elementos são apresentados na Tabela Periódica?
Cada elemento químico é caracterizado no Tabela periódica usando certa simbologia. Em primeiro lugar, no centro de cada caixa seu símbolo universal, que consiste em um ou dois letras (por convenção, se houver duas letras, a primeira é maiúscula e a próxima minúscula).
Acima e à esquerda aparece em uma pequena fonte su número atômico, que é o que indica a quantidade de prótons que esse elemento possui. Abaixo do símbolo do elemento, seu nome aparece e acima, à esquerda, seu nome aparece. massa atômica relativo. Além disso, a cor na qual o símbolo do elemento está representado significa o seu estado de agregação (de acordo com a representação utilizada em cada Tabela Periódica).
Os diferentes elementos presentes raios atômicos e, à medida que aumenta o número de prótons no núcleo, maior é a atração que o núcleo exerce sobre os elétrons, logo o raio atômico tende a diminuir. Quando o raio atômico é pequeno, os elétrons no nível mais externo da nuvem são muito atraídos para o núcleo, então eles não desistem facilmente. O oposto acontece com elementos com raios atômicos altos: eles abandonam seus elétrons externos facilmente.
Assim, o raio atômico aumenta de cima para baixo quando percorremos os grupos da Tabela Periódica e diminui da esquerda para a direita à medida que percorremos seus períodos.
Exemplos de elementos químicos
| Elemento químico | Símbolo |
| Actínio | Ac |
| Alumínio | Ao |
| Americium | SOU |
| Antimônio | Sb |
| Argônio | Ar |
| Arsênico | Ás |
| Astat | No |
| Enxofre | S |
| Bário | BA |
| Berílio | Ser |
| Berquélio | Bk |
| Bismuto | Bi |
| Bohrio | Bh |
| Boro | B |
| Bromo | Br |
| Cádmio | CD |
| Cálcio | AC |
| Californium | Cf |
| Carbono | C |
| Cério | CE |
| Césio | Cs |
| Cloro | Cl |
| Cobalto | Co |
| Cobre | Cu |
| cromada | Cr |
| Curium | Cm |
| Darmstadio | Ds |
| Disprósio | Dy |
| Dubnium | Db |
| Einsteinium | Isto é |
| Erbium | Er |
| Escândio | Sc |
| Lata | Sn |
| Estrôncio | Sr |
| Europium | Eu |
| Fermium | Fm |
| Flúor | F |
| Corresponder | P |
| Francius | Fr |
| Gadolínio | D'us |
| Gálio | Ga |
| Germânio | Ge |
| Háfnio | Hf |
| Hassio | Hs |
| Hélio | eu tenho |
| Hidrogênio | H |
| Ferro | Fé |
| Holmium | Ho |
| indiano | No |
| Iodo | eu |
| Iridium | Ir |
| Itérbio | Yb |
| Ítrio | E |
| Krypton | Kr |
| Lantânio | o |
| Lawrencio | Lr |
| Lítio | Li |
| Lutécio | seg |
| Magnésio | Mg |
| Manganês | Mn |
| Meitnerius | Mt |
| Mendelévio | Md |
| Mercúrio | Hg |
| Molibdênio | Mo |
| Neodímio | N / D |
| Néon | Ne |
| Neptúnio | Np |
| Nióbio | Nb |
| Níquel | Nenhum |
| Azoto | N |
| Nobelio | Não |
| Ouro | Au |
| Ósmio | Vocês |
| Oxigênio | OU |
| Paládio | P.S |
| Prata | Ag |
| Platina | Pt |
| Liderar | Pb |
| Plutônio | Pu |
| Polônio | Po |
| Potássio | K |
| Praseodímio | Pr |
| Promessa | PM |
| Protactínio | Pa |
| Rádio | Ra |
| Radon | Rn |
| Rênio | Ré |
| Ródio | Rh |
| Rubídio | Rb |
| Rutênio | Ru |
| Rutherfordio | Rf |
| Samário | vós |
| Seaborgio | Sg |
| Selênio | eu sei |
| Silício | sim |
| Sódio | N / D |
| Tálio | Tl |
| Tântalo | Ta |
| Tecnécio | Tc |
| Telúrio | Chá |
| Térbio | Tb |
| Titânio | Vocês |
| Tório | º |
| Túlio | Tm |
| Copérnico | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Está acordado |
| Flerovio | Fl |
| Ununseptio | Uus |
| Untrium | Uut |
| Urânio | OU |
| Vanádio | V |
| Tungstênio | C |
| Xenon | Xe |
| Zinco | Zn |
| Zircônio | Zr |

Siga com:
