30 exemplos de vendas binárias
Exemplos / / November 09, 2023
As sais binários (sais neutros) são formados quando um metal e um não metal se combinam. São compostos químicos composto por apenas dois elementos químicos. Por exemplo: cloreto de sódio (NaCl) e brometo de potássio (KBr).
- Veja também: Metais e não metais
Exemplos de sais binários
- Cloreto de sódio (NaCl)
- Cloreto de ferro (II) (FeCl2)
- Cloreto de ferro (III) (FeCl3)
- Sulfeto de cobalto (II) (CoS)
- Sulfeto de cobalto (III) (Co2Sim3)
- Sulfeto de chumbo (II) (PbS)
- Sulfeto de chumbo (IV) (PbS2)
- Cloreto de cálcio (CaCl2)
- Fluoreto de sódio (NaF)
- Cloreto de lítio (LiCl)
- Cloreto de estrôncio (SrCl2)
- Cloreto de bário (BaCl2)
- Cloreto de alumínio (AlCl3)
- Sulfeto de magnésio (MgS)
- Cloreto de rubídio (RbCl)
- Brometo de cálcio (CaBr2)
- Sulfeto de potássio (K2S)
- Brometo de magnésio (MgBr2)
- Sulfeto de zinco (Zn2S)
- Brometo de lítio (LiBr)
- Cloreto de níquel (NiCl2)
- Cloreto de urânio (III) (UCl3)
- Brometo de prata (AgBr)
- Iodeto de prata (AgI)
- Brometo de potássio (KBr)
Nomenclatura de sais binários
De acordo com a Nomenclatura Tradicional, os sais binários são nomeados escrevendo o nome do elemento não metálico com a desinência -ide. Por outro lado, o nome do elemento metálico é escrito de acordo com o seu estado de oxidação:
- Para o estado de oxidação mais baixo, é escrito com a desinência -oso. Por exemplo: cloreto ferroso (FeCl2), onde o ferro tem um estado de oxidação de 2+.
- Para o estado de oxidação mais elevado, é escrito com a desinência -ico. Por exemplo: cloreto férrico (FeCl3), onde o ferro tem um estado de oxidação de 3+.
De acordo com a Nomenclatura Sistemática, os sais binários são nomeados escrevendo o nome do elemento não metálico com um prefixo que indica a quantidade de átomos deste elemento no composto. Além disso, a desinência -uro é colocada no nome do elemento não metálico. Em seguida, é colocado o nome do elemento metálico. Por exemplo: dicloreto de magnésio (MgCl2) e tricloreto de ferro (FeCl3).
De acordo com a nomenclatura de Stock, os sais binários são nomeados escrevendo o nome do elemento não metálico com a desinência -ide. Em seguida, coloca-se o nome do elemento metálico seguido do seu estado de oxidação escrito em algarismos romanos e entre parênteses. Por exemplo: cloreto de ferro (II) (FeCl2) e sulfeto de cobalto (III) (Co2Sim3).
Aplicações de sais binários
- Eles são usados como refrigerantes nas indústrias alimentícia e farmacêutica. Por exemplo: cloreto de cálcio (CaCl2).
- Eles são usados para tratar superfícies metálicas contra corrosão. Por exemplo: fluoreto de sódio (NaF).
- Eles são usados para regular a umidade na indústria de papel e construção. Por exemplo: cloreto de cálcio (CaCl2).
- São utilizados na indústria do vidro para eliminar impurezas. Por exemplo: tetracloreto de silício (SiCl4).
- Eles são usados como ingredientes culinários. Por exemplo: cloreto de sódio (NaCl).
Propriedades físicas de sais binários
- Eles têm altos pontos de fusão porque são compostos de ligações ionicas.
- Eles conduzem corrente elétrica quando dissolvidos ou derretidos.
- Os sais mais comuns apresentam baixa dureza.
- Eles não são compressíveis.
- A maioria pode dissolver-se em água.
Como são obtidos os sais binários?
Os sais binários podem ser obtidos através de algumas das seguintes reações químicas:
Reação entre um metal e um não metal. Por exemplo: a reação entre sódio (Na) e dicloreto (Cl2) produz cloreto de sódio (NaCl).
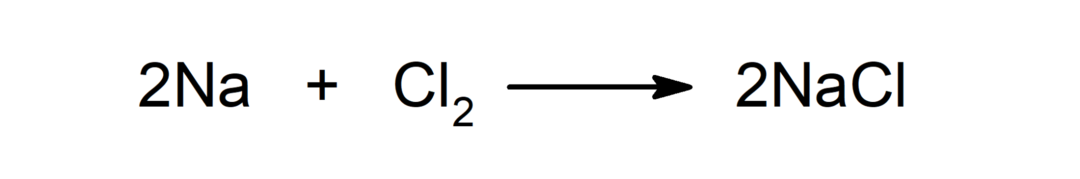
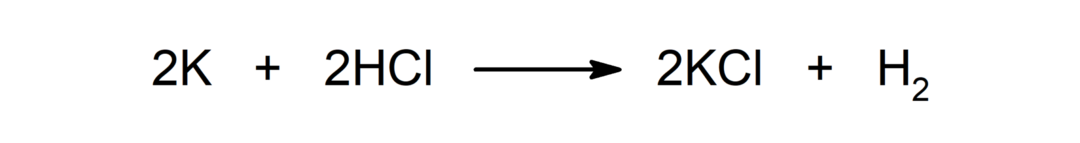
Reação entre um metal e um ácido. Por exemplo: A reação entre potássio (K) e ácido clorídrico (HCl) produz cloreto de potássio (KCl) e dihidrogênio (H2).
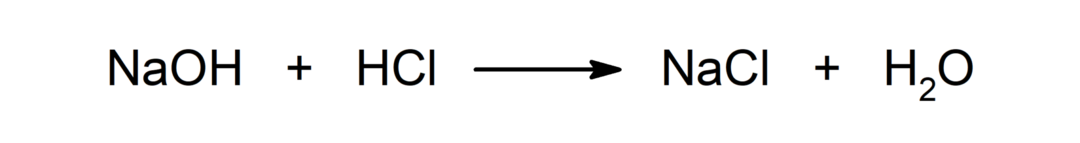
Reação entre um ácido e uma base. Por exemplo: A reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH) produz cloreto de sódio (NaCl) e água (H2QUALQUER).
Siga com:
- oxissais
- sais neutros
- sais ácidos
Referências
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juárez, E. (2020). Vídeo de nomenclatura 1: sais binários e reação química.
- Acurio Arias, M. V., & Delgado Méndez, M. E. (2022). Guia de aprendizagem baseado em jogos para “compostos binários” em Química do Ensino Médio na Unidade Educacional “Herlinda Toral” (Dissertação de bacharelado, Universidade Nacional de Educação).
- Cabreira, M. J. H. (2005). Estudo a partir de primeiros princípios de propriedades eletrônicas e estruturais de compostos binários e ternários (Dissertação de doutorado, Universidade de La Laguna).



