Exemplos de reações endotérmicas
Exemplos / / November 09, 2023
A reação endotérmica É uma reação que absorve energia do meio na forma de calor. Nessas reações, para que os reagentes se transformem em produtos, é necessário que estes absorvam calor, o que faz com que os produtos tenham maior energia que os reagentes que lhes deram origem. Alguns exemplos de reações endotérmicas são: fotossíntese e eletrólise da água.
- Veja também: Reações químicas
Exemplos de reações endotérmicas na vida cotidiana
Algumas das principais reações endotérmicas são:
Produção de ozônio na atmosfera. O ozônio é produzido na atmosfera quando o oxigênio molecular (O2) absorve a radiação ultravioleta e se decompõe. Então um átomo de oxigênio (O) pode interagir com outra molécula de oxigênio (O2) e formam ozônio (O3).

Eletrólise da água. É o processo pelo qual é aplicado energia elétrica à água para separá-la em seus dois componentes, hidrogênio (H) e oxigênio (O).
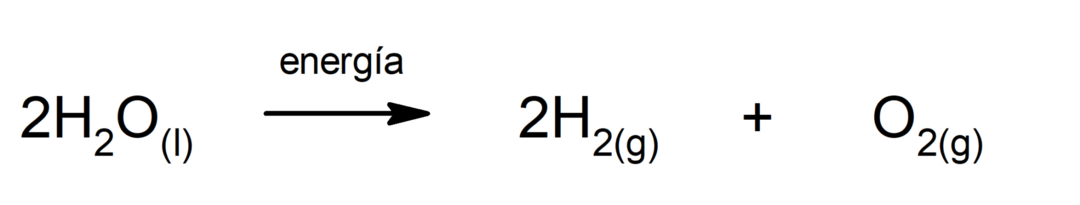
Fotossíntese. É a reação química pela qual, absorvendo energia solar, dióxido de carbono (CO2) é transformado em glicose. Esta reação constitui a principal via de nutrição das plantas.
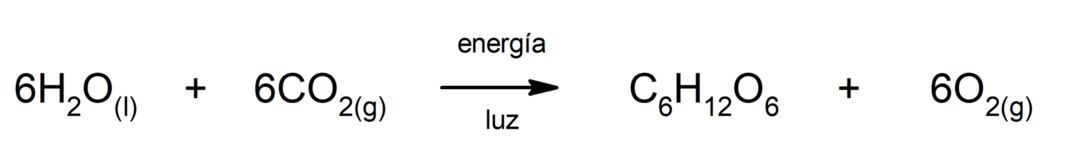
Produção de sulfeto de ferro (II). Para que ocorra a reação entre o enxofre e o ferro, é necessário fornecer energia na forma de calor.
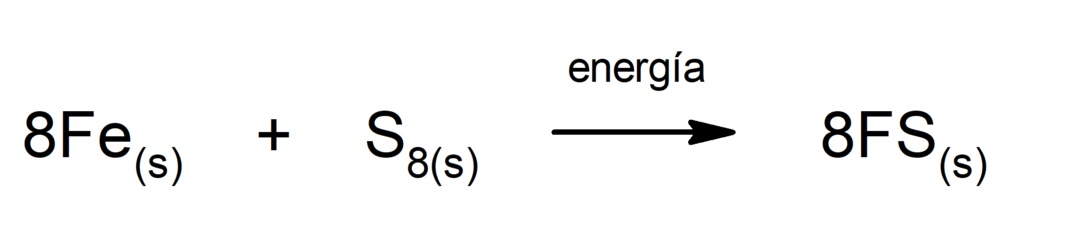
Decomposição de dióxido de carbono (CO2). A decomposição do CO2 Em altas temperaturas produz monóxido de carbono (CO) e oxigênio (O2).
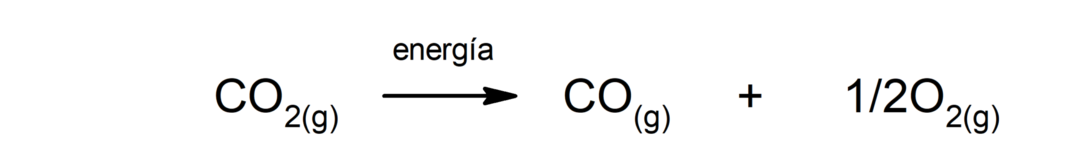
Decomposição de carbonato de cálcio (CaCO3). O carbonato de cálcio se decompõe com a absorção de calor para produzir óxido de cálcio (CaO) e dióxido de carbono (CO2).
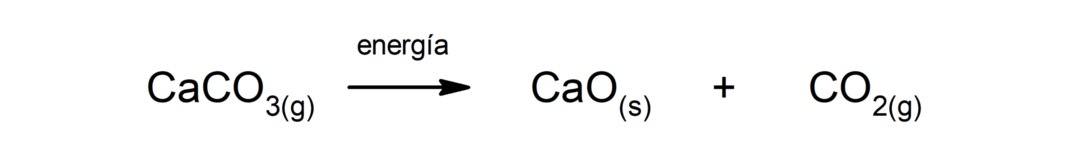
Diferença entre reação endotérmica e exotérmica
A principal diferença entre as reações endotérmicas e exotérmicas é que as reações endotérmicas absorvem calor, enquanto as reações exotérmicas liberam calor.
Além disso, as reações endotérmicas são caracterizadas por um aumento na entalpia, enquanto as reações exotérmicas estão associadas a uma diminuição na entalpia.
Entalpia é uma quantidade termodinâmica que define o fluxo de energia térmica a pressão constante durante uma reação química. É representada pela letra H, e sua variação é um dos principais indicadores para definir se uma reação química é endotérmica ou exotérmica.
- Se uma reação química tiver uma variação de entalpia maior que zero (ΔH > 0) é endotérmico.
- Se uma reação química tiver uma variação de entalpia menor que zero (ΔH < 0) é exotérmico.
Siga com:
- Fenômenos físico-químicos
- Química na vida cotidiana
- Química na vida cotidiana
- Química orgânica e inorgânica
Referências
- Soto-Córdoba, S. (2016). Reações Endotérmicas. Repositório de tecnologia Instituto Tecnológico da Costa Rica.
- Corominas, J. (2017). Reações químicas da vida cotidiana. Alambique, (90), 8-26.
- Sánchez, M. T. M., & Sánchez, M. M. (2002). Estudo experimental de reações endotérmicas para estudantes do ESO. Anais de Química da RSEQ, (4), 36-39.
