Exemplo de energia química
Química / / July 04, 2021
O Energia química é aquela que vem de reações químicas. A interação entre espécies químicas gera quebra e / ou geração de ligações, o que implica uma liberação ou absorção de Energia, respectivamente. A Energia Química é chamada de energia liberada, que pode ser utilizada como Energia Térmica e Energia Elétrica, por exemplo.
Energia em reações químicas
A Energia Química pode ser obtida em sua expressão máxima a partir de duas fontes principais: Combustão e Soluções Eletrolíticas. Por outro lado, ao nível do corpo humano, é possível obter energia através da desintegração química dos alimentos.
Energia de Combustão
Por exemplo, quando o metano de combustível CH4, o hidrocarboneto mais simples, começa a queimar na presença do Oxidante de Oxigênio, ele se desintegra, formando produtos de Dióxido de Carbono CO.2 e água H2OU. Além disso, a quebra das ligações dos átomos de hidrogênio com os átomos de carbono liberará energia na forma de calor.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 Kcal / mol
Equação de combustão do metano. O calor desta reação é representado por ΔH. O sinal negativo indica liberação de energia. A reação é exotérmica.
 Combustão de gás metano. A reação se manifesta com uma chama.
Combustão de gás metano. A reação se manifesta com uma chama.
Exemplos de Calores de Combustão de Compostos Orgânicos a 25 ° C.
Composto |
Fórmula |
ΔH (Kcal / mol) |
Metano (g) |
CH4 |
-212.80 |
Etano (g) |
C2H6 |
-372.82 |
Propano (g) |
C3H8 |
-530.60 |
n-butano (g) |
C4H10 |
-687.98 |
n-pentano (g) |
C5H12 |
-845.16 |
Etileno (g) |
C2H4 |
-337.23 |
Acetileno (g) |
C2H2 |
-310.62 |
Benzeno (g) |
C6H6 |
-787.20 |
Benzeno (l) |
C6H6 |
-780.98 |
Tolueno (l) |
C7H8 |
-934.50 |
Naftaleno (s) |
C10H8 |
-1,228.18 |
Sacarose (s) |
C12H22OU11 |
-1,348.90 |
Metanol (l) |
CH3Oh |
-173.67 |
Etanol (l) |
C2H5Oh |
-326.70 |
Ácido acético (l) |
CH3COOH |
-208.34 |
Ácido (s) benzóico (s) |
C6H5COOH |
-771.20 |
Para que um combustível forneça todo o calor de combustão de que é capaz, ele deve estar em estado gasoso. Como pode ser visto na tabela, o benzeno líquido contribui com um calor de combustão que é 6,22 Kcal / mol menor do que o liberado pelo benzeno gasoso. Isso significa que 6,22 Kcal / mol devem ser investidos para fazer a mudança de líquido para gasoso.
Clique para obter mais informações sobre o Combustíveis.
Energia de soluções eletrolíticas
Um condutor eletrolítico é um meio no qual uma ou mais espécies iônicas estão envolvidas, que é disperso com sua carga elétrica, permitindo que uma corrente elétrica passe através de seu Constituição. Soluções eletrolíticas são condutores eletrolíticos.
Os condutores eletrolíticos incluem, além das soluções eletrolíticas, Sais fundidos e também alguns sais sólidos, como cloreto de sódio NaCl e nitrato de prata AgNO3.
A transferência de elétrons ocorre por migração iônica, positiva e negativa, em direção aos eletrodos. Essa migração envolve não apenas uma transferência de eletricidade, mas também o transporte de matéria de uma parte do condutor para outra.
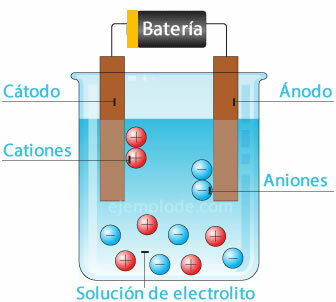 Célula eletroquímica
Célula eletroquímica
Conectando uma fonte potencial aos eletrodos metálicos (cátodo e ânodo), e submergindo-os em um Solução aquosa, os elétrons irão viajar através do ânodo, para escapar da solução para o pólo positivo do fonte. É o caso, por exemplo, de um íon cloreto, que é liberado de seu elétron, e já com carga neutra, ele se junta a outro átomo de cloro, para formar a molécula diatômica. O gás cloro escapará da solução.
2Cl- = 2Cl + 2e-
Os elétrons que saem do pólo negativo da fonte serão alojados no cátodo submerso. As espécies presentes na solução aquosa (íons) irão retirar os elétrons do cátodo. Por exemplo, os íons de hidrogênio que constituem a água, tendo uma carga positiva, levaram um elétron a ser neutralizado e unido a outro átomo de hidrogênio para formar a molécula diatômico. Ele escapará como gás hidrogênio da solução.
2h+ + 2e- = 2H
2H = H2 (g)
Essa troca de elétrons pode dar suporte ao funcionamento de baterias automotivas, que consistem em eletrodos de Chumbo Pb imersos em uma solução de Ácido Sulfúrico H2SW4.
Esta mesma energia é obtida em todos os tipos de pilhas que são tratadas a nível doméstico: 9V, AA, AAA, D, só para citar alguns exemplos.
Energia Alimentar
Os seres humanos assimilam a energia que é liberada ao desintegrar os alimentos que ingerimos em nosso corpo. Essa energia é a que nosso corpo usa para funções não conscientes (digestão, batimento cardíaco, funções celulares) e aquelas que realizamos.
Desde que você não tenha atividade física intensa e seu metabolismo seja lento, é aconselhável uma ingestão calórica regular, pois os alimentos ricos em Os lipídios e carboidratos complexos, que têm estruturas muito grandes, são mais difíceis de quebrar, resultando em uma reversão de Energia. Nesse caso, o efeito seria momentaneamente oposto.
É aconselhável consumir frutas quando for trabalhar à noite, pois a fruta contém frutose, um carboidrato simples que é fácil de quebrar e terá energia disponível para nós após sua consumo.
Energia Química e suas transformações
Usinas termelétricas
Os combustíveis pesados são usados em usinas termelétricas por apresentarem alto valor calorífico e de longa duração. Geralmente é óleo combustível (óleo combustível). A combustão, etapa química do processo, servirá como agente de aquecimento de uma caldeira, que gerará vapor saturado. Esse vapor sairá sob pressão pela rede de distribuição de vapor e começará a movimentar as turbinas dos geradores. Esses aparelhos estarão produzindo Energia Elétrica para abastecer a população correspondente.
Energia Química → Energia Mecânica → Energia Elétrica
Operação Automotiva
Os carros dependem de uma fonte de energia, que é a bateria. Na bateria, já se sabe que ocorre a condução eletrolítica, que alimenta o sistema de ignição, os acessórios do painel e as tomadas auxiliares. Graças a essa eletricidade disponível, o carro poderá se mover para levar o motorista ao local desejado.
Energia Química → Energia Elétrica → Energia Mecânica



