O que é eletrólise
Química / / July 04, 2021
Em Química, Eletrólise é o fenômeno em que uma corrente elétrica passa por uma solução aquosa de um composto iônico, e começa direcionar os íons (partículas carregadas) do Composto a dois eletrodos, positivo (Ânodo, atrai ânions carregados negativamente) e negativos (Cátodo, atrai cátions carregados positivamente). Este fenômeno é regido pela lei da eletrostática, que indica que cargas opostas se atraem.
Eletrólitos
Em 1883, Michael Faraday descobriram que soluções aquosas de certas substâncias conduzem corrente elétrica, enquanto soluções de outras substâncias não.
Para testar se uma solução aquosa conduz ou não corrente elétrica, Faraday projetou um aparelho simples que consiste em um Circuito de 110 volts DC, uma lâmpada, Y dois eletrodos de metal ou grafite conectados para a fonte atual.
Se os eletrodos estiverem imersos em água, a quantidade de corrente que flui é tão pequena que a lâmpada não acende; o mesmo é verdadeiro se eles forem mergulhados em uma solução de açúcar.
Pelo contrário, se eles estão imersos em uma solução de
Cloreto de Sódio NaCl ou de Ácido clorídrico HCl, a lâmpada brilha intensamente, o que prova que o dissolução é um excelente condutor. Por outro lado, usando ácido acético CH3Concentrado de COOH, a solução conduz mal a corrente, mas quando o Ácido é diluído com Água H2Ou, sua condutividade elétrica aumenta.Durante a passagem da corrente por diferentes soluções, diferentes produtos são obtidos nos eletrodos.
No curso de seus estudos sobre eletrólise, Faraday deduziu as seguintes leis:
1ª Lei: A quantidade de substância que tem sua transformação química em um eletrodo é proporcional à quantidade de eletricidade que passa pela solução.
2ª Lei: Se a mesma quantidade de eletricidade for passada por soluções diferentes, os pesos das substâncias decompostos ou depositados nos diferentes eletrodos são proporcionais aos pesos equivalentes dos referidos substâncias.
Para citar um exemplo:
Será assumido que você tem cinco células eletrolíticas diferentes. O primeiro com Ácido clorídrico HCl, o segundo com Sulfato de cobre CuSO4, o terceiro com Cloreto Antimonioso SbCl3, o quarto com SnCl de cloreto estanoso2 e o quinto com SnCl de cloreto estânico4.
A mesma corrente é passada por uma série de células eletrolíticas, até que sejam liberados 1.008 gramas de Hidrogênio (a Peso equivalente de hidrogênio) da solução de ácido clorídrico, os pesos (em gramas) dos demais produtos liberados no mesmo tempo Eles são:
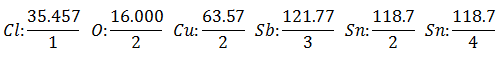
O Peso equivalente tem o valor de Peso Atômico do Elemento dividido pelo Valência do Elemento.
Para liberar um peso equivalente de qualquer item, você precisa 96500 coulombs. Esta quantidade de eletricidade é chamada 1 Faraday.
Unidade Faraday
Ampère é definido como um fluxo uniforme que deposita 0,001118 gramas de prata (Ag) a partir de uma solução de nitrato de prata (AgNO3) em um segundo. Uma vez que o peso atômico da prata é 107,88 g / mol, a proporção 107,88 / 0,001118 dá o número de amperes-segundos ou coulombs eletricidade necessária para depositar um equivalente químico de prata. Essa quantidade é 96494 Coulombs (o valor 96500 é aproximado para cálculos mais simples) e é chamada de 1 Faraday de Eletricidade.
Eletrodos
Faraday ligou Ânodo para eletrodo positivo e cátodo para eletrodo negativo. Ele também criou os termos ânion e cátion, aplicados às substâncias que aparecem respectivamente no ânodo e no cátodo durante a eletrólise.
Atualmente, outra definição para eletrodos é:
Ânodo: Eletrodo no qual há perda de elétrons ou oxidação.
Cátodo: Eletrodo no qual há ganho ou redução de elétrons.
Eletrólitos e não eletrólitos
A condução da corrente elétrica por meio de soluções não foi explicada de forma satisfatória até 1887, quando Svante Arrhenius divulgou sua teoria. Antes de apreciar e compreender a teoria de Arrhenius, primeiro apresentamos alguns dos fatos que eram conhecidos pela ciência quando Arrhenius a formulou:
As Soluções não eletrolíticas eles têm propriedades que podem ser calculadas pela aplicação da lei de Raoult. As pressões de vapor e os pontos de ebulição e congelamento observados dessas soluções são praticamente iguais aos valores calculados.
O Lei de Raoult explica que a Pressão de Vapor de cada Soluto em Solução depende de sua própria fração molar nele, multiplicada por sua Pressão de Vapor em seu estado puro.

A Lei de Raoult falha quando aplicada a soluções eletrolíticas em água. As variações da pressão de vapor e dos pontos de ebulição e congelamento são sempre maiores do que as previstas pela referida lei e, além disso, aumentam ao diluir.
Tais desvios são representados pelo valor i, que é a razão da variação observada no ponto de congelamento entre a variação calculada no ponto de congelamento:

O valor de i é uma medida do desvio da Lei de Raoult, sendo igual a 1 quando não há desvio.
Condutividade elétrica de eletrólitos
Arrhenius investigou a condutividade de soluções aquosas de eletrólitos para descobrir como a condutividade variava com a concentração de eletrólitos.
Ele mediu a condutividade molar (que é a condutividade correspondente a um mol de eletrólito dissolvido; ou seja, a condutividade específica referia-se a um mol e descobriu que aumentava com a diluição.
Arrhenius comparou seus resultados com medições de desvios da Lei de Raoult e encontrou uma relação estreita entre eles e a condutividade molar. Em sua teoria, o comportamento dos eletrólitos é explicado:
“As moléculas de eletrólito se dissociam em partículas eletricamente carregadas chamadas íons. A dissolução é incompleta e há um equilíbrio entre as moléculas e seus íons. Os íons conduzem a corrente conforme se movem dentro da solução ”.
Os desvios da Lei de Raoult são devidos ao aumento do número de partículas resultante da dissociação parcial das moléculas.
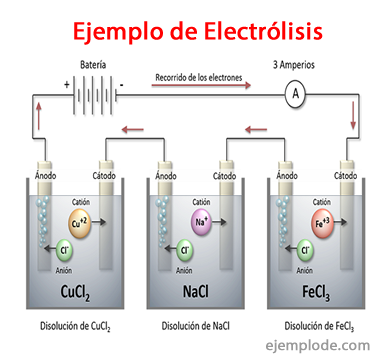
Exemplos de eletrólise
Algumas soluções que se comportam como eletrólitos, ou seja, possuem capacidade para eletrólise são:
Cloreto de Sódio NaCl
Ácido clorídrico HCl
Sulfato de Sódio Na2SW4
Ácido Sulfúrico H2SW4
Hidróxido de sódio NaOH
Hidróxido de amônio NH4Oh
Carbonato de Sódio Na2CO3
Bicarbonato de Sódio NaHCO3
Ácido Nítrico HNO3
Nitrato de prata AgNO3
Sulfato de Zinco ZnSO4



