Exemplo de compostos aromáticos
Química / / July 04, 2021
Os químicos descobriram que é útil dividir todos os compostos orgânicos em duas classes amplas: compostos Alifático e compostos Aromatico. Os compostos aromáticos são o benzeno e os compostos com comportamento químico semelhante. As propriedades aromáticas são o que distinguem o Benzeno dos Hidrocarbonetos Alifáticos. A molécula de benzeno é um anel de um tipo específico. Existem outros compostos, também em forma de anel, que parecem diferir estruturalmente do benzeno e, ainda assim, se comportam de maneira semelhante.
Acontece que esses outros compostos se assemelham ao benzeno em sua estrutura eletrônica básica, razão pela qual também se comportam como aromáticos.
Os hidrocarbonetos alifáticos (alcanos, alcenos, alcinos e seus análogos cíclicos) reagem principalmente por Adição, em vários links e por substituição de radical livre, em outros pontos da cadeia alifática.
Por outro lado, os hidrocarbonetos aromáticos, destaca-se que têm tendência a substituição heterolítica. Além disso, essas mesmas reações de substituição são características de anéis aromáticos onde quer que apareçam, independentemente de quais outros grupos funcionais a molécula possa conter. Esses últimos grupos afetam a reatividade dos anéis aromáticos e vice-versa.
A molécula de benzeno
O benzeno é conhecido desde 1825 e suas propriedades químicas e físicas são mais conhecidas do que as de qualquer outro composto orgânico. Apesar disso, não foi até 1931 que uma estrutura satisfatória foi proposta para este substância, e levou até 15 anos para estar em uso geral entre produtos químicos orgânico. A dificuldade residia nas limitações do desenvolvimento que a teoria estrutural havia alcançado até então. A estrutura final foi alcançada graças ao pressuposto de vários fatos importantes:
O benzeno tem a fórmula molecular C6H6. Devido à sua composição elementar e peso molecular, o benzeno era conhecido por ter seis átomos de carbono e seis de hidrogênio. O problema era saber a disposição desses átomos.
Em 1858, August Kekulé propôs que os átomos de carbono podem ser ligados entre si para formar cadeias. Mais tarde, em 1865, ele ofereceu uma resposta para o problema do benzeno: essas cadeias de carbonato às vezes podem ser fechadas, para formar anéis.
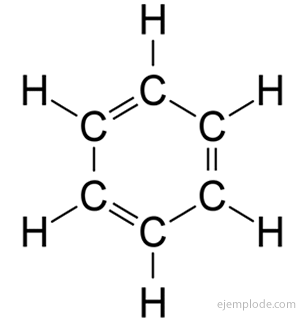
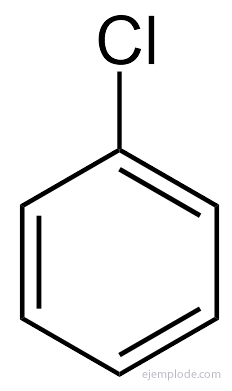
O benzeno dá apenas um produto C monossubstituído6H5Y. Por exemplo, quando um átomo de hidrogênio é substituído por Bromo, apenas uma única configuração de BromoBenzeno C é obtida.6H5Br; analogamente, um cloroBenzeno C também é obtido6H5Cl, ou um NitroBenzeno C6H5NÃO2etc. Este fato impõe uma limitação severa na estrutura do Benzeno: todo o seu Hidrogênio deve ser exatamente equivalentes, isto é, todos devem ser unidos a carbonos que, por sua vez, são todos igualmente vinculado. Não pode haver hidrogênio em CH3, e outros em CH2, e outros em CH. A estrutura final do monossubstituído deve ser a mesma para a substituição de qualquer Hidrogênio em Benzeno.
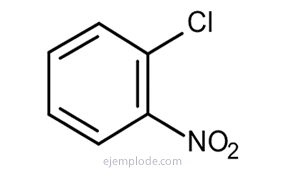
O benzeno dá três produtos isoméricos dissubstituídos, C6H4Y2 ou C6H4AND Z. Existem apenas três DiBromoBenzenos isoméricos, C6H4Br2, três cloroNitroBenzenos C6H4ClNO2etc. Este fato limita ainda mais as possibilidades estruturais.
O benzeno sofre reações de substituição, em vez de reações de adição. A estrutura do benzeno de Kekulé corresponde àquela que chamaríamos de Ciclohexatriene. Por isso, deve reagir facilmente por adição, como fazem os compostos semelhantes, ciclohexadieno e ciclohexeno, que é uma característica da estrutura dos alcenos. Mas esse não é o caso; sob condições em que os alcenos reagem rapidamente, o benzeno não reage, ou apenas muito lentamente. Em vez de reações de adição, o benzeno sofre facilmente um conjunto de reações, todas as quais são substituição, como a Nitração, a Sulfonação, a Halogenação, a Alquilação de Friedel-Crafts, a Acilação a partir de Friedel-Crafts. Em cada uma dessas reações, um átomo ou grupo foi substituído por um dos átomos de hidrogênio do benzeno.
A estabilidade do Benzeno se deve às duplas ligações alternadas e também à energia de ressonância, em aquele em que as ligações duplas mudam de posição entre os carbonos, mantendo a mesma alternância estrutural. Está energia de estabilização de ressonância é responsável pelo conjunto de propriedades chamadas Propriedades Aromáticas.
Uma reação de adição transforma um alceno em um composto saturado mais estável. Mas, no caso do benzeno, uma adição o torna menos estável, destruindo o sistema de anéis sustentado e estabilizado por ressonância. A molécula final seria ciclohexadieno. É por isso que a estabilidade do Benzeno o leva a apenas reações de Substituição.
Propriedades de compostos aromáticos
Além das substâncias que contêm anéis de benzeno, há muitas outras consideradas aromáticas, embora na superfície dificilmente tenham qualquer semelhança com o benzeno.
Do ponto de vista experimental, os compostos aromáticos são substâncias cujas fórmulas moleculares sugerem um alto grau de insaturação, apesar de que eles são resistente a reações de adição tão característico de compostos insaturados.
Em vez disso, esses compostos aromáticos um frequentemente sofrem reações de substituição eletrofílica semelhantes aos do benzeno. Junto com essa resistência à adição, e provavelmente por causa dela, há evidências de um estabilidade incomum, como baixas temperaturas de hidrogenação e combustão.
Substâncias aromáticas são cíclicas, geralmente apresentando anéis de cinco, seis e sete átomos, e seu exame físico mostra que eles têm moléculas planas ou quase planas. Seus prótons têm o mesmo tipo de deslocamento químico nos espectros de ressonância magnética nuclear do benzeno e seus derivados.
Do ponto de vista teórico, para uma substância ser aromática, sua molécula deve ter nuvens cíclicas de elétrons π deslocalizados acima e abaixo do plano da molécula; Além disso, essas nuvens π devem conter um total de (4n + 2) elétrons π; isso significa que a deslocalização não é suficiente para resultar na estabilidade particular que caracteriza um composto aromático.
Nomenclatura de derivados de benzeno (compostos aromáticos)
No caso de muitos desses derivados, principalmente nos monossubstituídos, basta colocar o grupo substituinte para a palavra Benzeno, como, por exemplo, CloroBenzeno, BromoBenzeno, IodoBenzeno, Nitrobenzeno.
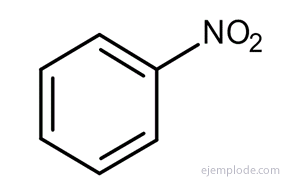
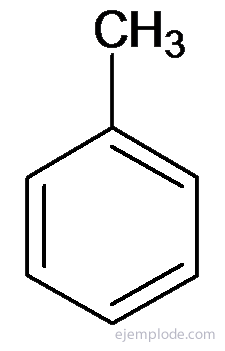
Outros derivados têm nomes especiais que podem não ter semelhança com o nome do grupo substituinte. Por exemplo, Metil Benzeno é conhecido apenas como Tolueno; AminoBenzene as Aniline; Hidroxibenzeno como fenol, etc.
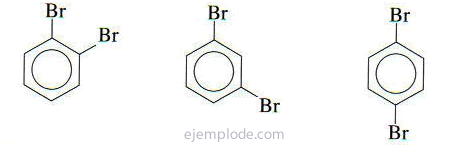
Se houver dois grupos ligados ao anel benzênico, é necessário não apenas identificar o que são, mas também indicar sua localização relativa. Os três isômeros possíveis para benzenos dissubstituídos são caracterizados pelos prefixos orto, meta e para, abreviados o-, m-, p-. Por exemplo: o-DiBromoBenzeno, m-DiBromoBenzeno, p-DiBromoBenzeno.
Se um dos dois grupos for do tipo que dá à molécula um nome especial, o composto é denominado como um derivado dessa substância especial. Por exemplo: NitroTolueno, Bromofenol, etc.
Exemplos de compostos aromáticos
Tolueno ou Metilbenzeno
Etilbenzeno
Isopropilbenzeno
TriNitroToluene ou TNT
Anilina ou Aminobenzeno
Ácido benzóico
Ácido Glutâmico ou Ácido ParaAminoBenzoico
Ácido tolueno sulfônico
Fenol ou Hidroxibenzeno
Bromofenol
Tricloro benzeno
Éter fenil benzeno
Benzeno de iodo
Bromo benzeno

