Características dos lantanídeos
Química / / July 04, 2021
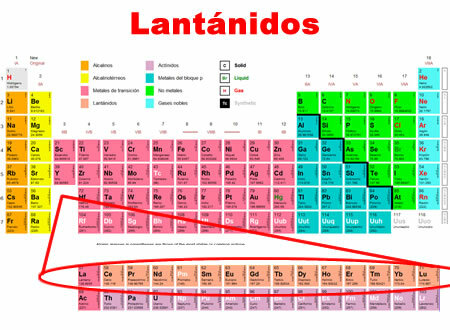
Lantanídeos são os elementos químicos que variam do lantânio ao lutécio. Eles compartilham características comuns, pelas quais são classificados em uma categoria especial na parte inferior da tabela periódica.
Principais características dos lantanídeos:
- Eles estão localizados no período 6 da tabela periódica.
- Eles cobrem 15 elementos, de 57 a 71.
- Eles compartilham a estrutura do lantânio, ao qual é adicionado um nível de energia f, que é menos reativo quimicamente.
- Elas eram chamadas de terras raras porque em um estado natural sempre se combinavam para formar óxidos.
- Alguns são relativamente abundantes.
- Embora tenham valências variáveis, a maioria tem valências +3.
- À medida que seu número atômico aumenta, seu raio diminui.
- Todos eles têm uma aparência metálica brilhante.
Características individuais dos lantanídeos:
Lantânio (La).
- Número atômico 57
- Peso Atômico: 139
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 920 ° C
- Ponto de ebulição: 3457 ° C
Foi descoberto em 1839. Na indústria, é usado em ligas com outros lantanídeos para fazer pedras mais leves; na óptica, é usado para vidros ópticos. Também é usado para esponjas de hidrogênio, usadas para conter gases. Na medicina é utilizado na forma de carbonato de lantânio, para o tratamento da insuficiência renal, pois tem afinidade para se misturar com os fostatos, reduzindo a hiperfosfemia.
Cério (Ce)
- Número atômico 58
- Peso Atômico: 140
- Estado: Sólido macio
- Aparência: Metálico, cinza prateado, semelhante a ferro
- Valências: +3, +4
- Ponto de fusão: 798 ° C
- Ponto de ebulição: 3426 ° C
Foi descoberto em 1803. É o lantanídeo mais abundante. É utilizado na fabricação de catalisadores, principalmente para automóveis (conversores catalíticos) e para craqueamento de petróleo. Na forma de óxido, é usado para polir vidros e lentes. Embora não tenha funções biológicas conhecidas, na medicina é usado em pomadas para queimaduras.
Praseodímio (Pr)
- Número atômico 59
- Peso atômico: 144
- Estado: Sólido macio
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 931 ° C
- Ponto de ebulição: 3520 ° C
Foi descoberto em 1841 e isolado em 1885. Na indústria, é usado em ligas com magnésio para a fabricação de motores de aviões; É usado para dar ao vidro e aos esmaltes uma cor amarela. As ligas de níquel têm propriedades magnéticas. Reage com halogênios para produzir fluoretos, cloretos, brometos e iodetos.
Neodímio (Nd)
- Número atômico 60
- Peso Atômico: 139
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1024 ° C
- Ponto de ebulição: 3100 ° C
Foi descoberto em 1885, quando o praseodímio foi isolado; o neodímio foi isolado até 1925. É um dos lantanídeos mais reativos. Na indústria, é utilizado para colorir vidros e esmaltes. Devido à sua capacidade de absorver luz, é usado em astronomia para criar cristais com os quais os espectrômetros e filtros infravermelhos são calibrados. Um de seus principais usos é a fabricação de ímãs de alta intensidade magnética. Esses ímãs são usados para instrumentos de precisão, como aqueles usados em discos rígidos de computador, bem como alguns alto-falantes de formato fino.
Promécio (Pm)
- Número atômico 61
- Peso Atômico: 145
- Estado sólido
- Aparência: ?
- Valência: +3
- Ponto de fusão: 1100 ° C
- Ponto de ebulição: 3000 ° C
Sua existência foi prevista em 1902, mas não pôde ser provada até 1944. Este lantanídeo não é encontrado na natureza, sendo a fonte de sua obtenção e estudo a fissão do urânio. Quando o urânio é dividido em um reator nuclear, um dos átomos que são produzidos a partir dessa separação atômica é o promécio. Possui características radioativas, que lhe conferem fosforescência, e é utilizado para calibradores e baterias nucleares de espaçonaves.
Samário (Sm)
- Número atômico 62
- Peso Atômico: 150
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1072 ° C
- Ponto de ebulição: 1803 ° C
Foi descoberto em 1853 e isolado em 1879. Possui vários isótopos, e pelo menos dois deles são radioativos. Na indústria, é usado em óptica para fazer cristais que absorvem luz infravermelha. Também é usado como catalisador para a obtenção de álcool e como elemento em algumas lâmpadas fluorescentes e televisores. Em termos de saúde, se inalado (como o óxido usado para polir cristais), pode causar embolias pulmonares ou afetar o fígado. Os isótopos radioativos são usados na radioterapia de pacientes terminais.
Europium (Eu)
- Número atômico 63
- Peso Atômico: 152
- Estado sólido
- Aparência: Metálico, branco prateado
- Valências: +2, +3
- Ponto de fusão: 826 ° C
- Ponto de ebulição: 1527 ° C
Foi descoberto em 1890. É o mais reativo dos lantanídeos. Tem sido utilizado em lâmpadas fluorescentes e televisores, porém por causar embolia pulmonar se estiver inalado ou danifica o fígado se acumulado no corpo humano, quase não tem uso industrial. Na pesquisa atômica, é usado porque absorve nêutrons.
Gadolínio (Gd)
- Número atômico 64
- Peso Atômico: 157
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1312 ° C
- Ponto de ebulição: 3250 ° C
O gadolínio tem poucos usos, sendo o principal deles a refrigeração industrial magnética, pois aumenta suas propriedades magnéticas em baixas temperaturas; mas como esse tipo de resfriador requer o uso de arsênico, eles não são usados na refrigeração doméstica. Na medicina, é usado como meio de contraste para ressonância magnética nuclear.
Térbio (Tb)
- Número atômico 65
- Peso Atômico: 159
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +4
- Ponto de fusão: 1356 ° C
- Ponto de ebulição: 3230 ° C
Foi descoberto em 1843 e isolado em 1905. É muito importante na indústria eletrônica, pois é um dos elementos utilizados na fabricação de semicondutores. Outros usos são para fazer tubos fluorescentes e tubos de imagem. Também é usado como catalisador em células de combustível. Embora não tenha funções biológicas, sua inalação ou entrada no corpo humano tem efeitos tóxicos, afetando principalmente o fígado.
Disprósio (Dy)
- Número atômico 66
- Peso atômico: 162,5
- Estado sólido
- Aparência: Metálico, branco prateado
- Valências: +2, +3
- Ponto de fusão: 1407 ° C
- Ponto de ebulição: 2567 ° C
Foi descoberto em 1843 e isolado em 1905. É muito importante na indústria eletrônica, pois é um dos elementos utilizados na fabricação de semicondutores. Outros usos são para fazer tubos fluorescentes e tubos de imagem. Também é usado como catalisador em células de combustível. Embora não tenha funções biológicas, sua inalação ou entrada no corpo humano tem efeitos tóxicos, afetando principalmente o fígado.
Holmium (Ho)
- Número atômico 67
- Peso Atômico: 166
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1474 ° C
- Ponto de ebulição: 2700 ° C
Foi descoberto em 1878 e seu nome deriva da cidade do seu descobrimento, Estocolmo, em latim, Holmia. Quase não tem usos práticos; no entanto, é usado em algumas indústrias como um catalisador para reações químicas, bem como para alguns componentes eletrônicos. Também é usado para alterar a frequência e a intensidade do feixe de laser.
Erbium (Er)
- Número atômico 68
- Peso Atômico: 167
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1795 ° C
- Ponto de ebulição: 2863 ° C
Foi descoberto em 1843. É usado na indústria nuclear como tampão de nêutrons. Na forma de óxido, é um corante para cristais, o que lhes dá uma tonalidade rosa; Esses cristais são usados em ótica e joias. Também é usado para fazer fibras ópticas.
Túlio (Tm)
- Número atômico 69
- Peso Atômico: 167
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1545 ° C
- Ponto de ebulição: 1947 ° C
Foi descoberto em 1879. Apesar de sua baixa disponibilidade, devido às suas características radioativas, seu principal uso é como fonte de raios-X em equipamentos portáteis e para lasers de estado sólido.
Itérbio (Yb)
- Número atômico 70
- Peso Atômico: 173
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 824 ° C
- Ponto de ebulição: 1194 ° C
Foi descoberto em 1878 e isolado em 1907. Os isótopos radioativos são usados para equipamentos portáteis de raios-X que funcionam sem eletricidade. Também é utilizado para melhorar ligas de aço e aumentar sua resistência, característica utilizada na odontologia, devido ao aprimoramento das propriedades mecânicas do aço. Deve ser manuseado com cuidado, pois pode causar irritações e queimaduras. Além disso, ao reagir com o ar, pode causar explosão ou incêndio.
Lutécio (Lu)
- Número atômico 71
- Peso Atômico: 175
- Estado sólido
- Aparência: Metálico, branco prateado
- Valência: +3
- Ponto de fusão: 1652 ° C
- Ponto de ebulição: 3402 ° C
Foi descoberto em 1907. É o elemento químico menos abundante na crosta terrestre. Apesar de sua baixa disponibilidade, é utilizado para refino de petróleo e como catalisador para reações de química orgânica. Alguns isótopos radioativos também foram testados para tratamentos de radioterapia.