Exemplo de Elementos Químicos
Química / / July 04, 2021
Um elemento químico é uma substância pura composta de átomos do mesmo tipo, por sua vez, formou por uma série de prótons e nêutrons no núcleo, e uma quantidade de elétrons em seus orbitais. Alguns são encontrados naturalmente, outros formando as moléculas de um composto e outros foram criados por meio da execução de procedimentos laboratoriais. Todos os elementos químicos constituem a matéria de todo o universo e sustentam a existência e o funcionamento do corpo humano.
Cada elemento possui características e comportamentos que o diferenciam e o tornam único, mas ao mesmo tempo apresenta semelhanças com um grupo de elementos na manifestação que eles têm na universo. Por esse motivo, existe a Tabela Periódica dos Elementos Químicos, que aborda essas semelhanças para agrupar de forma coerente os elementos e facilitar o estudo de suas propriedades.
Número atômico de um elemento
O átomo carrega no núcleo uma série de prótons, acompanhados pelo mesmo número de nêutrons. Para este número é chamado de número atômico
, representado como Z para fins acadêmicos e na literatura. Para cada elemento, este número será único. Não existem dois elementos com o mesmo número atômico. A Tabela Periódica também enfoca este critério para ordená-los.Símbolo de um Elemento
Nos tempos da Alquimia, que durou aproximadamente o ano 400 a 1000 DC. C., os Alquimistas registraram seus experimentos atribuindo símbolos aos elementos. Eram símbolos simples, feitos com figuras geométricas, para representar o elemento individual e as transformações estudadas.
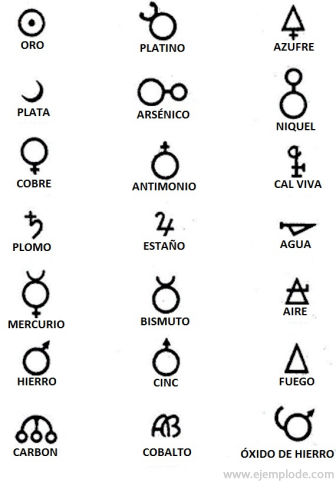
Alguns exemplos de símbolos alquímicos, com o nome do elemento ou composto que representam.
Na Era da Química Moderna, os Elementos ainda são representados por símbolos, neste caso letras que se referem ao seu nome em latim ou inglês.
Por exemplo:
O símbolo para o sódio é N / D, por seu nome latino Natrium
O símbolo de ouro é Au, por seu nome latino Aurum
O símbolo para prata é Ag, por seu nome latino Argentum
O símbolo do cobre é Cu, por seu nome latino Cuprum
O símbolo do Antimônio é Sb, por seu nome latino Stibium
O símbolo do Ferro é Fé, por seu nome latino Ferrum
O símbolo de Mercúrio é Hg, por seu nome latino Hydrargyrum, que significa "prata líquida"
O símbolo do potássio é K, por seu nome latino Kalium
Grupos de elementos químicos:
A Tabela Periódica de Elementos Químicos os classifica por grupos: grupos A e grupos B. Os grupos A são oito, que contêm os elementos Alcalino, a Alcalino-Terroso, a Terreos, três famílias de Elementos, cujo chefe define o nome da família: Família Carbono, Família de nitrogênio, Família Enxofre, a Halogênios e os gases nobres. Os grupos B são compostos por todos os Metais de transição e as Terras Raras, que também são duas grandes famílias: Lantanídeos Y Actinides.
Grupo IA: Elementos Alcalinos:
A série de elementos alcalinos é composta por Hidrogênio (H), Lítio (Li), Sódio (Na), Potássio (K), Rubídio (Rb), Césio (Cs) e Franço (Fr). Todos eles têm uma configuração eletrônica de forma que na última camada eles têm um elétron. Seu nome se deve ao fato de que, ao entrarem em contato com a água, reagem formando Alcalis ou Hidróxidos. É um comportamento geral entre esses elementos. Quanto maior o átomo do elemento, mais reativo ele é, pois a força com a qual o núcleo retém o elétron da última camada tem cada vez menos alcance. Eles são capazes de formar ligações iônicas com halogênios. Por exemplo: A ligação iônica que tem presença abundante é a do Cloro-Sódio, formando Cloreto de Sódio NaCl.
Grupo IIA: Elementos Alcalino-Terrestres:
Esses elementos são: Berílio (Be), Magnésio (Mg), Cálcio (Ca), Estrôncio (Sr), Bário (Ba) e Rádio (Ra). Eles não são livres por natureza; por outro lado, seus carbonatos e silicatos existem em relativa abundância. São argentinos brancos e cristalinos. Eles se combinam facilmente com o oxigênio se expostos ao ar. Isso se deve, em parte, ao fato de eles possuírem dois elétrons em sua última camada, o que é consistente com a capacidade de recepção de oxigênio. O Bário é o elemento mais ativo do grupo e, junto com o Cálcio, são os que têm mais aplicações industriais no grupo.
Grupo IIIA: Elementos Terrestres:
O Grupo IIIA compreende os elementos Boro (B), Alumínio (Al), Gálio (Ga), Índio (In) e Tálio (Tl). O Boro é um elemento não metálico, o Alumínio é anfiprótico (anfiprótico), ou seja, é capaz de atuar como ácido e como base; e os outros três são elementos metálicos. Eles têm três elétrons em sua última camada, gerando uma valência de +3, embora às vezes o Gálio atue com valência +1 e +2 em alguns de seus compostos. O boro é o único elemento desta série que forma hidretos. O boro e o alumínio formam carbonetos.
Grupo IVA: Família de carbono:
Os elementos representativos do grupo IVA são Carbono (C), Silício (Si), Germânio (Ge), Estanho (Sn) e Chumbo (Pb). Os dois primeiros são fundamentalmente não metálicos em suas características, mas o germânio, o estanho e o chumbo são metálicos, e quanto mais, maior seu número atômico. Com exceção do Silício, cada elemento possui as valências +4 e +2.
Carbono e silício formam compostos nos quais os átomos dos elementos são unidos por pares de elétrons compartilhados. Carbono é a essência dos compostos orgânicos por associação com átomos de hidrogênio, oxigênio, nitrogênio, enxofre e, às vezes, silício.
O silício e o germânio são utilizados na fabricação de componentes eletrônicos, pois possuem a propriedade de se comportarem como semicondutores.
Grupo VA: Família de nitrogênio:
O Grupo VA compreende os elementos Nitrogênio (N), Fósforo (P), Arsênio (As), Antimônio (Sb) e Bismuto (Bi). O nitrogênio e o fósforo são não metálicos, o arsênico e o antimônio são metalóides e o bismuto é um metal. Esses elementos são caracterizados pela formação de Hidretos, dos quais o menos tóxico é o Amônia NH3. O nitrogênio forma ácido nítrico HNO3, envolvido junto com o Ácido Clorídrico em Água Régia, uma mistura capaz de dissolver metais preciosos como Ouro e Prata.
O nitrogênio também está envolvido em dois grandes grupos de compostos orgânicos chamados aminas e amidas, que podem ser considerados derivados da amônia NH3, por substituição de um hidrogênio por uma cadeia de hidrocarboneto.
Grupo VIA: Família de oxigênio:
Composto pelos elementos Oxigênio (O), Enxofre (S), Selênio (Se), Telúrio (Te) e Polônio (Po). O oxigênio é o mais ativo e tem a capacidade de formar ligações covalentes facilmente. Em contato com metais em ambiente de alta umidade, forma óxidos. Forma uma molécula ressonante chamada ozônio, que protege o planeta da radiação ultravioleta.
Grupo VIIA: Halogênios:
Seu nome significa "Formadores de vendas". O grupo é formado pelos elementos Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I) e Astato (At). Eles têm sete elétrons na última camada, o que permite que sejam receptores de um elétron. Essa qualidade faz com que eles se liguem aos elementos do grupo IA, formando sais binários. O flúor se caracteriza por ter a maior Eletronegatividade de toda a Tabela Periódica, com um valor de 4,0, sendo sua contrapartida o Césio, com eletronegatividade de 0,7. Esta propriedade permite que ele tenha força para atrair outros átomos e dar prioridade para formar uma ligação com eles.
Grupo VIIIA: Gases Nobres:
Também denominado Grupo de Gases Inertes, é formado pelos elementos Hélio (He), Néon (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe) e Radônio (Ra). São os elementos que possuem toda a sua configuração eletrónica completa, pelo que não são capazes de reagir nas condições habituais. São utilizados principalmente para letreiros luminosos comerciais, emitindo luz visível quando uma corrente elétrica incide sobre eles.
Grupos B: Metais de transição:
Em dez grupos de três elementos cada, os metais de transição são agrupados. Estes incluem os melhores condutores elétricos: Prata (Ag), Cobre (Cu), Ouro (Au); os melhores componentes estruturais para construção urbana e engenharia; Ferro (Fe), Titânio (Ti), Alumínio (Al), Zircônio (Zr), Tungstênio (W); os melhores componentes do catalisador: Níquel (Ni), Vanádio (V), Platina (Pt); e os principais ingredientes do revestimento: Cádmio (Cd), Cromo (Cr), Zinco (Zn). Eles geralmente lidam com valências entre +1 e +3, mas elementos como o Chromium lidam com valências +2, +3, +6.
Terras raras: Lantanídeos e Actinídeos:
Eles são chamados de Terras Raras por sua escassez no planeta. Eles são formados por dois grupos: Lantanídeos e Actinídeos. Eles são encontrados nas duas linhas separadas da Tabela Periódica. Eles trabalham com uma valência de +3 geralmente e tendem a formar hidróxidos. O elemento mais importante entre eles é o Cério, que é utilizado na preparação de ligas pirofóricas (Liga Mischmetal, para pedras mais leves), em mangueiras de gás para iluminação e na fabricação de vidros especiais que absorvem os raios ultravioleta e as radiações de calor.
Os elementos radioativos mais poderosos, como Urânio (U) e Plutônio (Pu), fazem parte desses grupos. que dada sua instabilidade, liberam energia e se desintegram, perdendo partículas Alfa (núcleos de Hélio). Mais tarde, eles se tornam elementos menos instáveis, de acordo com a série radioativa.



