Exemplo de moléculas orgânicas e inorgânicas
Química / / July 04, 2021
O Química Geral é a ciência que estuda todos os tipos de matéria que existem, e seu mudanças internas ter contato entre diferentes tipos deste.
O Quimica Organica É a parte da Química Geral destinada a estudar a matéria cujo principal constituinte é o Elemento carbono, e que faz parte dos organismos vivos.
O Química Inorgânica É a parte da Química Geral que se encarrega de estudar os chamados "matéria mineral", que faz parte do Eu não vivo meio ambiente.
O Molécula é a união de vários átomos de diferentes elementos produtos químicos para formar novas substâncias, com suas propriedades particulares.
Em Química Geral, Elementos são as substâncias puras que são formados por átomos de um único tipo. Os Elementos são classificados na Tabela Periódica dos Elementos Químicos.
Igual a ele Atom é a unidade fundamental dos Elementos, a Molécula é a unidade principal dos Compostos, que são substâncias que possuem um comportamento químico característico.
O Compostos pode ser formado como consequência de
fenômenos naturais, ou ser criado em laboratórios ou em Plantas industriais, então as moléculas estão presentes em todos os lugares. As moléculas estão nos minerais, nas folhas das árvores, nos alimentos, nos medicamentos, na água que bebemos, no ar que respiramos e até na poluição do meio ambiente.Química Geral é principalmente dividida em Química Inorgânica Y Químicopara OrgnI Ca, então as moléculas também podem ser classificadas em inorgânicas e orgânicas.
Moléculas Inorgânicas
Na Química Inorgânica, as moléculas são formadas principalmente pela combinação de átomos de valências positivas com outros de valências negativas, em ligações iônicas. Essas ligações são formadas principalmente pelas forças eletromagnéticas entre os átomos, geradas pela presença dos elétrons de valência.
Assim surgem todos os compostos iônicos, como Sais, Oxisal, Ácidos, Oxiácidos, Óxidos e Hidróxidos.
Moléculas inorgânicas como eletrólitos
A principal propriedade das moléculas iônicas é que quando elas entram em contato com a Água H2OU, eles são separados em suas duas partes: positiva e negativa. Essas duas partes, átomos eletricamente carregados ou grupos de átomos, estão dispersos na água. Para a substância inorgânica capaz de se separar em água, é chamado de eletrólito.
A solução formada por água e partículas carregadas positiva e negativamente é chamada "Solução eletrolítica". Esse tipo de solução tem a capacidade de conduzir correntes elétricas, por isso é utilizado em células eletroquímicas, como baterias de automóveis.
Ácido inorgânico e moléculas alcalinas
No caso de moléculas inorgânicas, como Ácidos, a Oxiácidos e os Hidróxidos, ao mesmo tempo que se separam em uma parte positiva e outra negativa, eles contribuem para a Solução uma propriedade chamada Potencial de Hidrogênio, medido como o logaritmo negativo da concentração de íons de hidrogênio.
O Potencial de hidrogênio (pH) determina o quanto a solução é ácida. Na escala de pH, que varia de um valor de 1 para acidez máxima a 14, que é alcalinidade ou basicidade completa, o caráter ácido varia de valores de 1 a 6, e o alcalino está entre 8 e 14. 7 representa pH neutro; nem ácido nem básico. O resultado do logaritmo negativo da concentração H + nos dirá onde estamos na escala.
Exemplos de ácidos:
Ácido clorídrico: HCl: H+ + Cl-
Ácido bromídrico: HBr: H+ + Br-
Ácido Sulfídrico: H2S: 2H+ + S-2
Ácido cianídrico: HCN: H+ + CN-
Ácido clorídrico: HI: H+ + I-
Exemplos de oxiácidos:
Ácido Sulfúrico: H2SW4: 2H+ + SO4-2
Ácido carbônico: H2CO3: 2H+ + CO3-2
Ácido Nítrico: HNO3: H+ + NÃO3-
Ácido Fosfórico: H3PO4: 3H+ + PO4-3
Ácido Perclórico: HClO4: H+ + ClO4-
Exemplos de hidróxidos:
Hidróxido de sódio: NaOH: Na+ + OH-
Hidróxido de cálcio: Ca (OH)2: Ca+ + 2OH-
Hidróxido de amônio: NH4OH: NH4+ + OH-
Hidróxido de potássio: KOH: K+ + OH-
Hidróxido de magnésio: Mg (OH)2: Mg+ + 2OH-
Moléculas inorgânicas em reações químicas
Quando as moléculas inorgânicas participam de uma reação química, pode haver quatro mecanismos básicos e simples de reação: Síntese, Decomposição, Substituição Simples e Substituição Dupla. Aqui está um exemplo de cada um:
Síntese

Uma reação de síntese é aquela em que duas moléculas se unem em um produto final que consiste em uma única molécula. No exemplo, é o caso do óxido de cálcio se combinando com o dióxido de carbono para formar uma molécula de carbonato de cálcio.
Decomposição:

Uma reação de decomposição é aquela em que uma molécula inicial se separa em duas novas moléculas estáveis. É o caso do Hidróxido de Cálcio, que se separa em uma molécula de Óxido de Cálcio e outra de Água.
Substituição Simples:

Em uma reação de substituição simples, um átomo de um elemento é trocado por um dos átomos de uma molécula. É o caso do Zinco metálico, que se posiciona no lugar do Hidrogênio no Cloreto de Hidrogênio, liberando-o e formando moléculas de Cloreto de Zinco.
Substituição dupla:

Em uma reação de dupla substituição, certos átomos de duas moléculas iniciais são trocados, para gerar duas moléculas diferentes como produtos. É o caso do Carboneto de Cálcio, que sofre liberação de Carbono, que se combinará com o Hidrogênio da Água para formar o Acetileno. O cálcio se liga ao oxigênio para formar o óxido de cálcio como um segundo produto.
Moléculas orgânicas
Química Orgânica é Química do Carbono, o que significa que todas as Moléculas Orgânicas terão a presença desse elemento, em diferentes arranjos estruturais.
Moléculas orgânicas são caracterizadas por presença constante de ligações covalentes. Ligações covalentes com aquelas em que dois átomos se unem para compartilhar seus elétrons de valência e, assim, completam seus octetos mutuamente.
É o caso do carbono, que se liga a outros átomos do mesmo elemento. Formam-se cadeias de comprimentos muito variados, de dois a sessenta átomos de carbono, e mesmo essas cadeias eles se ramificam com outras cadeias com a mesma variedade de comprimentos, alcançando uma imensa diversidade de moléculas orgânico.
Ligações iônicas também estão presentes, mas elas ocorrem em etapas intermediárias de mecanismos de longa reação em que uma molécula desejada é formada.
As moléculas orgânicas mais simples incluem carbono e hidrogênio. Este último completa a valência de carbono que o requer.
Em Química Orgânica, as moléculas podem ser lineares ou alifáticas, ramificadas, cíclicas e aromáticas.

Além disso, nas Moléculas Orgânicas estão envolvidos os elementos Oxigênio, Nitrogênio, Enxofre e Fósforo, o que origina uma diversidade impressionante de Grupos Funcionais para as moléculas.
Grupos funcionais em moléculas orgânicas
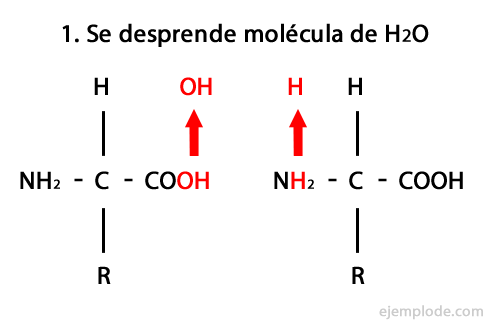
O Grupos Funcionais são grupos de dois ou mais átomos que, quando unidos a uma cadeia de Carbono-Hidrogênio, formam diferentes espécies químicas, com um comportamento particular. A seguir, os sete principais tipos de moléculas orgânicas são listados, com seus respectivos grupos funcionais. A letra "R" é usada para denotar a cadeia de carbono-hidrogênio.
Halogenetos de alquila - Forma: R-X / Grupo Funcional: Um elemento de halogênio (cloro, bromo, iodo)

Alcoóis - Forma: R-OH / Grupo Funcional: -OH ou Hidroxil.

Aldeídos - Forma: R-CHO / Grupo Funcional: -CHO, que sempre vai para o final da cadeia.

Cetonas - Forma: R-CO-R / Grupo Funcional: -CO- ou Carboxi, sempre no Carbono médio da cadeia.

Ácidos orgânicos - Forma: R-COOH / Grupo Funcional: -COOH ou Carboxil, sempre no final da cadeia.

Ésteres ácidos - Forma: R-COO-R / Grupo Funcional: -COO-, é o resultado da união de uma cadeia ácida com outra cadeia Carbono-Hidrogênio.

Aminas - Formulário: R-NH2, R-NH-R, R-N-2R / Grupo Funcional: -NH2, -NH-, -N = ou Amino, que é um nitrogênio suplementado com hidrogênio em locais onde não há cadeia de carbono-hidrogênio. Conforme declarado, ele pode ir no final da cadeia ou no meio. O átomo de nitrogênio pode ser acompanhado por uma, duas ou três cadeias orgânicas para formar uma molécula final. As aminas podem ser consideradas derivados orgânicos da amônia NH3.

Moléculas orgânicas em reações químicas
As moléculas orgânicas, quanto mais longas suas cadeias de carbono-hidrogênio, mais sítios ou átomos disponíveis para participar de uma reação química.
Na maioria das vezes, elementos ou cadeias são adicionados a um dos carbonos presentes, ou uma parte da cadeia principal é separada para gerar um composto orgânico diferente.
Como essas reações são demoradas, são usados catalisadores, que são agentes químicos para acelerar as reações. Em alguns casos, o Catalyst é uma malha fina de metal Platinum.
Exemplos de moléculas inorgânicas
Cloreto de Sódio NaCl
Cloreto de potássio KCl
Cloreto de Amônio NH4Cl
Nitrato de sódio NaNO3
Nitrato de potássio KNO3
Nitrato de Amônio NH4NÃO3
Ácido Sulfúrico H2SW4
Ácido Fosfórico H3PO4
Ácido Fósforo H3PO3
Ácido clorídrico HCl
Ácido iodídrico HI
Hidróxido de sódio NaOH
Hidróxido de potássio KOH
Hidróxido de amônio NH4Oh
Hidróxido de cálcio Ca (OH)2
Hidróxido de magnésio Mg (OH)2
Hidróxido ferroso Fe (OH)2
Hidróxido férrico Fe (OH)3
Sulfeto de ferro FeS
Sulfato Ferroso FeSO4
Sulfato Férrico Fe2(SW4)3
Exemplos de moléculas orgânicas
Glicose C6H12OU6
Metano CH4
Etano C2H6
Acetileno C2H2
Propano C3H8
Butano C4H10
Etanol C2H6OU
Sacarose C12H22OU11
Metanol CH4OU
Glicerol C3H8OU3