Exemplo da Lei de Carlos
Física / / July 04, 2021
A lei do gás de Charles ou lei da pressão constante, é outra das leis do gás, enunciada por Gay-Lussac, que deu a conhecer a obra de Jacques Charles, publicada por volta de 20 anos antes.
A lei de Charles prevê o comportamento de uma massa de gás quando a pressão permanece constante e a temperatura e o volume variam.
A lei de Charles é declarada da seguinte forma:
Em pressão constante, o volume de um gás é diretamente proporcional à mudança em sua temperatura.
Pressão constante: refere-se ao fato de que a pressão que o gás exerce nas paredes do recipiente não irá variar ao longo da experiência.
Volume: é o espaço ocupado que o gás ocupa, em geral é considerado um recipiente com paredes que não se deformam e cuja tampa funciona como um êmbolo.
Temperatura: É o aumento ou perda de calor que o gás sofre durante a experimentação. Se a temperatura aumentar, o volume aumenta. Se a temperatura diminuir, o volume também diminui.
Algebricamente, a Lei de Charles é expressa com a seguinte fórmula:

Onde:
V = volume de gás
T = temperatura do gás
k = constante de proporcionalidade para essa massa de gás.
Isso significa que para uma dada massa de gás, a pressão constante, a relação entre o volume e o variações de temperatura, terão sempre a mesma relação de proporcionalidade, representada pela constante k:

Assim, uma vez que a constante é determinada, podemos calcular qualquer um dos outros valores a partir dos outros dados conhecidos:
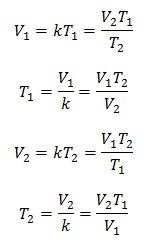
3 Exemplos da Lei de Charles aplicada a problemas:
Exemplo 1: Calcule o novo volume, se em um recipiente existe uma massa de gás que ocupa um volume de 1,3 litros, a uma temperatura de 280 K. Calcule o volume ao atingir a temperatura de 303 K.
V1 = 1,3 l.
T1 = 280 K
V2 = ?
T2 = 303 K
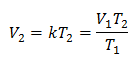
Substituindo valores:
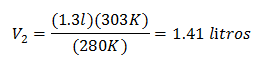
O novo volume de 303 K é 1,41 litros.
Exemplo 2. Se tivermos um gás que ocupa 2,4 litros a 10 graus Celsius, calcule a temperatura final, se no final ele ocupa 2,15 litros.
V1 = 2,4 l
T1 = 10 ° C = 283 K
V2 = 2,15 l
T2 = ?
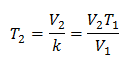
Substituindo valores:
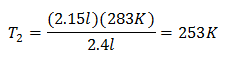
A nova temperatura é 253 K, que é igual a -20 ° C.
Exemplo 3. Temos um gás para o qual sabemos que sua temperatura inicial é 328 K, seu volume final é 3,75 l e sua constante de razão é 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
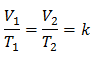
Substituindo valores:
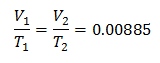
Para saber o volume inicial:
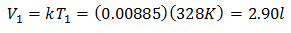
O volume inicial é de 2,90 l.
Para saber a temperatura final:
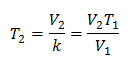
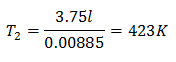
A temperatura final será de 423 K, o que equivale a 150 ° C.
