100 de exemple de elemente chimice
Miscellanea / / November 13, 2021
The elemente chimice sunt un tip de materie care prin nicio procedură sau reactie chimica ele pot fi reduse sau descompuse în alte elemente mai simple. Din acest motiv, se poate spune că un element este totul materie facut de atomi din aceeași și unică clasă, adică atomi care au același număr atomic (număr egal de protoni), deși au masă atomică diferită. De exemplu: sulf, bor, crom, staniu.
Prima definiție a unui element chimic a fost introdusă de Lavoisier la Traite Élémentaire de Chimie, în 1789. În secolul al XVIII-lea, Lavoisier a subdivizat substanțele simple în patru grupe:
Tabelul periodic al elementelor
Astăzi se cunosc 118 elemente chimice. Toate sunt adunate, clasificate și organizate în funcție de multe dintre proprietățile lor într-o schemă grafică cunoscută sub numele de Tabelul Periodic al Elementelor, care a fost creat inițial de chimistul rus. Dimitri Mendeleiev în 1869. Tabelul periodic este compus din 18 grupe (coloane) și 7 perioade (rânduri), în care se află elementele chimice.
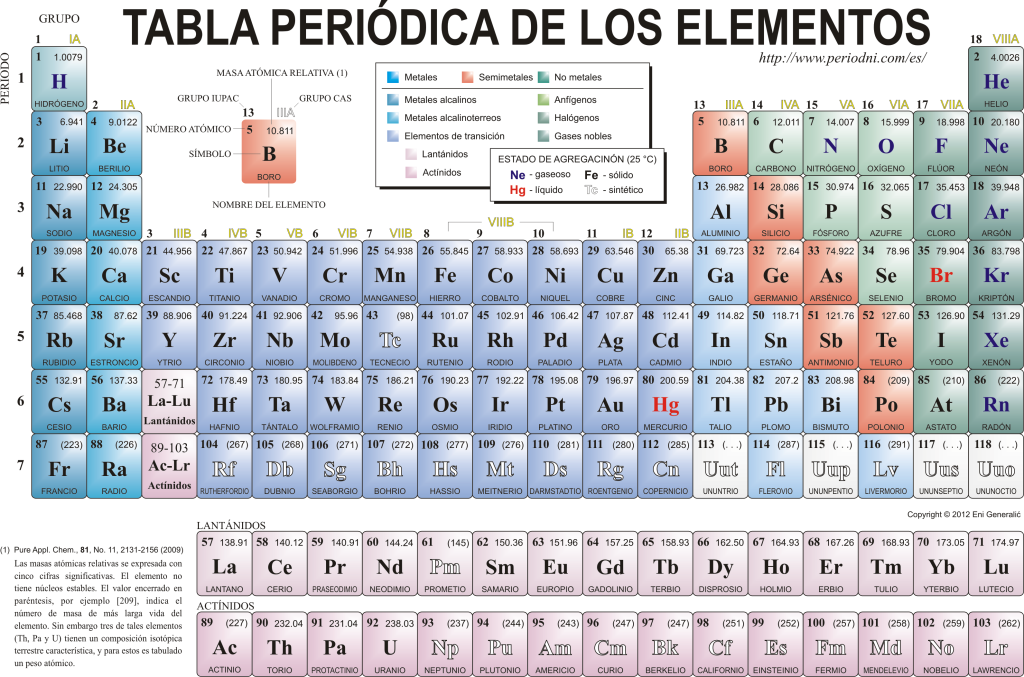
The grupuri principale care pot fi găsite în acest tabel sunt:
Metalele alcaline (Grupa 1), metalele alcalino-pământoase (Grupa 2), familia scandiului, care include pământurile și actinidele (Grupa 3), familia titanului (Grupa 4), familia vanadiului (Grupa 5), familia cromului (Grupa 6), familia manganului (Grupa 7), familia fierului (Grupa 8), familia cobalt (Grupa 9), familia nichel (Grupa 10), familia cuprului (Grupa 11), familia zincului (Grupa 12), elementele pământului (Grupa 13), elementele carbonide, în această grupă se află Carbonul, care constituie baza vieții pe Pământ (Grupa 14), elementele formatoare de azot (Grupa 15), elementele amfigenetice, include oxigenul, element fundamental pentru cel respiraţie al fiinte vii (Grupa 16), elemente cu halogen (Grupa 17) și gaze nobile (Grupa 18).
Multe dintre aceste elemente au izotopi stabili sau radioactivi, adică același element chimic, de exemplu, hidrogenul (H), poate avea mai mulți izotopi (1H, 2H, 3H). Aceasta înseamnă că fiecare atom izotop are același număr de protoni (ceea ce înseamnă că aparține aceluiași element chimic) și un număr diferit de neutroni.
Unii izotopi nu sunt stabili (radioactivi), adică dezintegra într-un anumit timp, emite anumite particule (neutroni, fotoni, particule alfa, printre altele) și generează alți izotopi stabili sau radioactivi. Elementele chimice au proprietăți precum punctul de fierbere iar cea de fuziune, electronegativitate, densitate și raza ionică, printre altele. Aceste proprietăți sunt importante deoarece ne permit să prezicem comportamentul, reactivitatea, etc.
Cum sunt prezentate elementele în tabelul periodic?
Fiecare element chimic este caracterizat în Tabelul periodic folosind o anumită simbologie. În primul rând, în centrul fiecărei casete simbolul său universal, care constă din unul sau doi litere (prin convenție, dacă sunt două litere, prima se scrie cu majuscule și următoarea cu litere mici).
Deasupra și în stânga apare cu caractere mici su numar atomic, care este cea care indică cantitatea de protoni pe care o are acest element. Sub simbolul elementului apare numele acestuia iar deasupra, în stânga, apare numele acestuia. masă atomică relativ. În plus, culoarea în care este reprezentat simbolul elementului semnifică starea sa de agregare (conform reprezentării utilizate în fiecare Tabel Periodic).
Diferitele elemente prezente razele atomice variabile și, pe măsură ce numărul de protoni din nucleu crește, cu atât este mai mare atracția pe care nucleul o exercită asupra electronilor, astfel încât raza atomică tinde să scadă. Când raza atomică este mică, electronii de la nivelul cel mai exterior al norului sunt foarte atrași de nucleu, așa că nu renunță ușor. Opusul se întâmplă cu elementele cu raze atomice mari: își renunță cu ușurință electronii exteriori.
Astfel, raza atomică crește de sus în jos când parcurgem grupele din Tabelul Periodic și scade de la stânga la dreapta pe măsură ce trecem prin perioadele lor.
Exemple de elemente chimice
| Element chimic | Simbol |
| actiniu | Ac |
| Aluminiu | La |
| Americiu | A.M |
| Antimoniu | Sb |
| argon | Ar |
| Arsenic | As |
| Astat | La |
| Sulf | S |
| Bariu | Ba |
| Beriliu | Fi |
| Berkeliu | Bk |
| Bismut | Bi |
| Bohrio | Bh |
| Bor | B |
| Brom | Br |
| Cadmiu | CD |
| Calciu | AC |
| Californiu | Cf |
| Carbon | C |
| ceriu | EC |
| cesiu | Cs |
| Clor | Cl |
| Cobalt | Co |
| Cupru | Cu |
| Crom | Cr |
| Curium | Cm |
| Darmstadio | Ds |
| Disprosiu | Dy |
| Dubnium | Db |
| Einsteiniu | Este |
| Erbiu | Er |
| Scandiul | Sc |
| Staniu | Sn |
| Stronţiu | Domnul |
| Europiu | Eu |
| Fermium | Fm |
| Fluor | F |
| Meci | P |
| Francius | pr |
| Gadoliniu | Gd |
| Galiu | Ga |
| germaniu | GE |
| hafniu | Hf |
| Hassio | Hs |
| Heliu | eu am |
| Hidrogen | H |
| Fier | Credinţă |
| Holmiu | Ho |
| indian | În |
| Iod | eu |
| Iridiu | A merge |
| Iterbiu | Yb |
| ytriu | ȘI |
| Krypton | Kr |
| Lantan | The |
| Lawrence | Lr |
| Litiu | Li |
| lutețiu | Lun |
| Magneziu | Mg |
| Mangan | Mn |
| Meitnerius | Mt |
| Mendeleviu | Md |
| Mercur | Hg |
| Molibden | lu |
| Neodim | N / A |
| Neon | Ne |
| Neptuniu | Np |
| Niobiu | Nb |
| Nichel | Nici |
| Azot | N |
| Nobelio | Nu |
| Aur | Au |
| Osmiu | Tu |
| Oxigen | SAU |
| Paladiu | P.S |
| Argint | Ag |
| Platină | Pt |
| Conduce | Pb |
| Plutoniu | Pu |
| Poloniu | Po |
| Potasiu | K |
| Praseodimiu | Relatii cu publicul |
| Promisiune | P.m |
| Protactiniu | Pa |
| Radio | Ra |
| Radon | Rn |
| reniu | Re |
| Rodiu | Rh |
| Rubidiu | Rb |
| Ruteniu | Ru |
| Rutherfordio | Rf |
| Samariul | Voi |
| Seaborgio | Sg |
| Seleniu | știu |
| Siliciu | da |
| Sodiu | N / A |
| Taliu | Tl |
| Tantal | Ta |
| Tehnețiu | Tc |
| Telurul | Ceai |
| terbiu | Tb |
| Titan | Tu |
| toriu | Th |
| Tuliu | Tm |
| Copernic | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uraniu | SAU |
| Vanadiu | V |
| Tungsten | W |
| Xenon | Xe |
| Zinc | Zn |
| zirconiu | Zr |

Urmărește cu:

