Definiţia Molecular Geometry
Miscellanea / / January 11, 2022
Definiție conceptuală
Este structura unei molecule care determină aranjarea tridimensională a atomilor care o alcătuiesc în spațiu.

Inginer chimist
Geometriile moleculare sunt definite în prezent pe baza Teorie de repulsie a perechilor electronice ale stratului Valencia (TRPECV). Această teorie permite prezicerea comportamentului chimic de substanțe (în special covalente) și ajută la înțelegerea distributie electronice, conducând la geometrie al moleculă. Acest lucru, la rândul său, ne permite să înțelegem multe dintre proprietățile pe care le dobândesc substanțele.
Această Teorie se bazează pe o serie de piloni fundamentali pe care îi vom trece în revistă și apoi vom încerca să-i înțelegem aplicarea practică. În primul rând, electronii legați și nelegați (de valență) sunt considerați o mare de electroni care, prin posedă același tip de sarcină, se resping reciproc, deci vor fi întotdeauna situate cât mai departe de atomul central al moleculă.
În al doilea rând, această „mare” de electroni sau „nor electronic” formează zone cu densități mari de electroni, care sunt constituite în legături, unde electronii sunt împărțiți sau în perechi de electroni neîmpărțiți. La rândul lor, legăturile care se formează pot fi simple, duble sau chiar triple.
În fine, pentru decide geometrie moleculară, este foarte util să existe structura Lewis, unde se va număra cantitatea de densități de electroni din jurul atomului central și aceasta va da indicaţie de la numele geometriei sale și forma pe care molecula o ia tridimensional.
De remarcat faptul că aceste densități vor fi amplasate cât mai departe una de cealaltă, pentru a adopta cea mai stabilă structură și acolo unde este mai puțină repulsie. Așa se identifică mai întâi geometria electronică și apoi geometria moleculară.
Șase niveluri de densitate
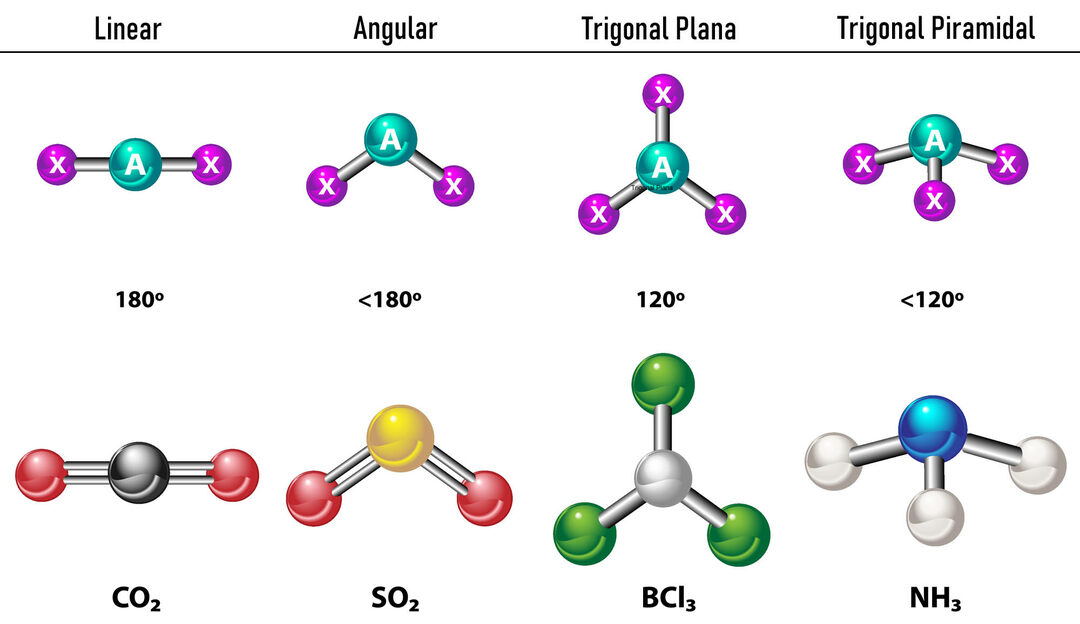
În cazul în care există două densități de electroni în jurul atomului central, legăturile vor fi situate cât mai departe unul de celălalt. între ele, adică la 180º unul de celălalt și, prin urmare, geometria lor electronică este liniară și moleculară este, de asemenea, liniară.
În cazul în care există trei densități de electroni în jurul atomului central, există două opțiuni: trei legături sau două legături și o pereche nelegată. Dacă există trei legături, geometria electronică este Trigonal plat, cu unghiuri de 120º între legături și geometria moleculară poartă același nume. Acum, dacă există o pereche nelegată, se resping reciproc cu mai mult intensitate că, prin urmare, sarcinile legate tind să comprime unghiurile de legătură. Unghiul dintre perechea liberă și fiecare legătură este de 120º, iar geometria electronică este plan trigonal, în timp ce geometria moleculară este unghiulară.
În cazul în care există patru densități de electroni în jurul atomului central, geometria electronică este tetraedrică. Dacă toate cele patru perechi de electroni sunt legate, geometria lor moleculară coincide ca nume cu geometria lor electronică, iar unghiul de legătură este de 109,5º. Acum, dacă una dintre perechi este liberă, unghiul de legătură devine mai mic (107º) și geometria moleculară este de tip Piramida trigonală. În cele din urmă, dacă două sunt perechi libere și două sunt legate, unghiul de legătură este de 104,5º în timp ce geometria moleculară se numește unghiular.
Când densitățile de electroni din jurul atomului central sunt de cinci, se numește a Bipiramida trigonală geometria sa electronică. Dacă toate sarcinile sunt legate, există unghiuri de 120°C între legăturile situate ecuatorial și 90° între cele axiale cu cele echiatoriale. Acum, geometria moleculară mai este numită și Bipiramidă Trigonală, în timp ce, având patru perechi legate și o pereche liberă, geometria moleculară este distorsionată formând binecunoscutul "rocker”, Acolo este numele pe care îl dobândește Tetraedru distorsionat. În timp ce, dacă două din cele cinci perechi de electroni sunt libere și trei dintre ei sunt legați, acesta are o geometrie în formă de „T” și numele său se datorează tocmai structurii sale. În cele din urmă, dacă este invers, trei perechi libere și două sarcini legate, geometria moleculară este liniară.
În cele din urmă, există șase densități de electroni în jurul atomului central și se formează un octaedru, de unde și numele său în geometria electronică. În mod similar, geometria moleculară este numită dacă toate perechile sale sunt legate. Dacă aveți cinci perechi legate și o pereche liberă, geometria moleculară este piramida de bază pătrată. Dacă aveți patru perechi legate și două perechi libere, geometria moleculară este Plat pătrat.
Figura: Natură dulce
Subiecte de geometrie moleculară

