Concept în definiția ABC
Miscellanea / / April 22, 2022
definirea conceptului
Azeotropii sunt amestecuri de compuși chimici, cu o compoziție definită, care fierb la anumite temperaturi. Caracteristica fundamentală este că amestecul se comportă ca și cum ar fi o singură substanță pură, păstrându-și proprietățile și oferind ușurință în manipulare.

Inginer chimist
Amestecul poate fi dat de două sau mai multe componente și acesta compoziţie este la fel atat in faza lichida cat si in faza gazoasa, acest lucru genereaza asemanari cu substantele pure. Din aceasta, se deduce cu ușurință că acest amestec nu poate fi separat în componentele sale prin procese precum distilare fracționată deoarece, așa cum sa menționat mai sus, își va păstra proporțiile, comportându-se ca și cum ar fi un singur componentă.
O altă caracteristică este că punctul de fierbere al acestui amestec poate fi mai mare, mai mic sau chiar egal cu cel al unuia dintre componentele sale. Când azeotropul fierbe la a temperatura de fierbere maximă, este cunoscut ca azeotrop maxim iar când o face la cea mai scăzută temperatură posibilă este cunoscut ca azeotrop minim. Aceasta înseamnă că azeotropul minim are un punct de fierbere mai mic decât componentele sale pure și invers cu azeotropul maxim. De exemplu, în amestecul metanol - benzen, azeotropul este minim (0,61 benzen - 0,39 metanol în fracții molar) al cărui punct de fierbere este de 58 °C, într-un rezervor în care punctul de fierbere al benzenului este de 80 °C și cel al metanolului 65°C
Azeotropii minime și maxime
Acum... de unde provine un azeotrop? Când există o abatere de la Lege Raoult, adică presiunea de vapori a amestecului azeotrop nu este direct legată de fracția sa molară, este atunci când apare conceptul de amestec azeotrop. Aceste abateri apar atunci când componentele se atrag sau se resping în mod semnificativ unele pe altele, adică forțele intermoleculare sunt foarte diferite în diferiți compuși.
Când abaterea este pozitivă, avem azeotropul minim, în timp ce dacă abaterea este negativă, avem azeotropul maxim. Pentru a înțelege mai bine acest concept, să ne uităm la câteva grafice:
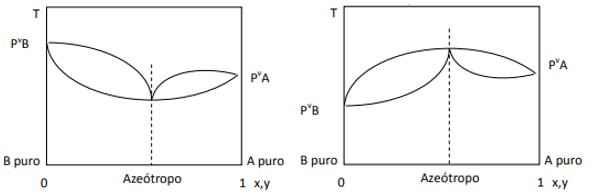
Aici observăm că, dacă amestecul ar fi ideal, prin Legea lui Raoult, presiunile de vapori ale componentelor pure ar trebui unite printr-o linie dreaptă, deoarece Ei bine, există o abatere de la acea lege care determină formarea azeotropilor minime și maxime, în funcție de faptul că există o afinitate mai mare sau mai mică între componente. Când abaterea la legea lui Raoult este negativă, ca în figura din stânga, este un minim la diagramă de presiune, dar un maxim în diagrama temperaturii (deci, azeotrop de maxim). Pe de altă parte, dacă abaterea este pozitivă față de Legea lui Raoult, va fi un maxim în presiunea vs. compoziție, dar un minim în diagrama temperaturii vs. compoziție (aici avem un azeotrop minim). Nu confunda diagramele presiunea vs. compoziție și temperatură vs. compoziţie.
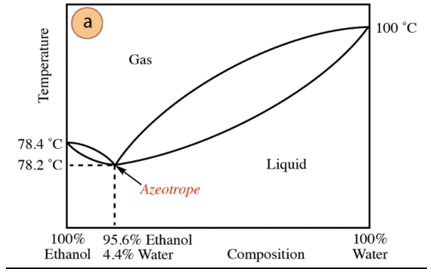
În cazul amestecului etanol-apă, există un azeotrop minim a cărui compoziție este 95,6% etanol și 4,4% apă. Temperatura de fierbere a amestecului azeotrop este cu 78,2 °C mai mică decât cea a componentelor pure. Deci, să presupunem că distila un amestec apă-etanol cu un conținut ridicat de apă (aproape de 100%). Nu se va putea obține alcool pur, deoarece se vor obține fracții mai mari în fiecare etapă de distilare. de etanol, dar nu ajungând niciodată la 100%, se va apropia treptat de compoziția amestecului azeotrop (punctul cel mai scăzut sub). De aceea, ca și apa, are tendința de a forma azeotropi minime cu compusi organici (având în vedere tipul de forțe intermoleculare care interacționează), este necesară îndepărtarea în prealabil a apei din amestec pentru a obține compusul pur. Sau, odata obtinut azeotropul, metode de extracţie de apă suplimentară.
Pe baza celor de mai sus, nu este întâmplător să găsești alcool (în supermarket și farmacie) la 95%, este cel mai ieftin produs care poate fi obtinut. Pentru a obține alcool pur, este necesar să „rupem” azeotropul cu tehnică suplimentar, cum ar fi utilizarea agenților de uscare sau a distilațiilor azeotrope. Distilarea azeotropă constă în adăugarea unui component suplimentar la amestec care acționează prin antrenare și prin interacţiune cu oricare dintre componentele amestecului (afinitate mai mare) poate fi îndepărtată din amestec.
Subiecte în azeotropi