Exemple de reacții endoterme
Exemple / / November 09, 2023
A reacție endotermă Este o reacție care absoarbe energie din mediu sub formă de căldură. În aceste reacții, pentru ca reactanții să se transforme în produse, este necesar ca aceștia să absoarbă căldură, ceea ce face ca produsele să aibă o energie mai mare decât reactanții care le-au dat naștere. Câteva exemple de reacții endoterme sunt: fotosinteza și electroliza apei.
- Vezi si: Reacții chimice
Exemple de reacții endoterme în viața de zi cu zi
Unele dintre principalele reacții endoterme sunt:
Producția de ozon în atmosferă. Ozonul este produs în atmosferă atunci când oxigenul molecular (O2) absoarbe radiațiile ultraviolete și se descompune. Apoi un atom de oxigen (O) poate interacționa cu o altă moleculă de oxigen (O2) și formează ozon (O3).

Electroliza apei. Este procesul prin care se aplică energie electrică la apă pentru a o separa în cele două componente ale sale, hidrogen (H) și oxigen (O).
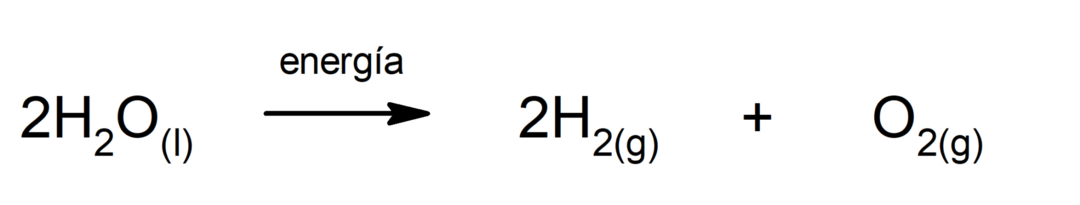
Fotosinteză. Este reacția chimică prin care, absorbind energie solara, dioxid de carbon (CO2) se transformă în glucoză. Această reacție constituie principala cale de nutriție a plantelor.
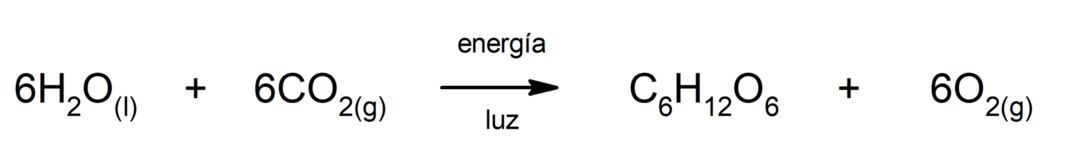
Producția de sulfură de fier (II).. Pentru ca reacția dintre sulf și fier să aibă loc, este necesar să se furnizeze energie sub formă de căldură.
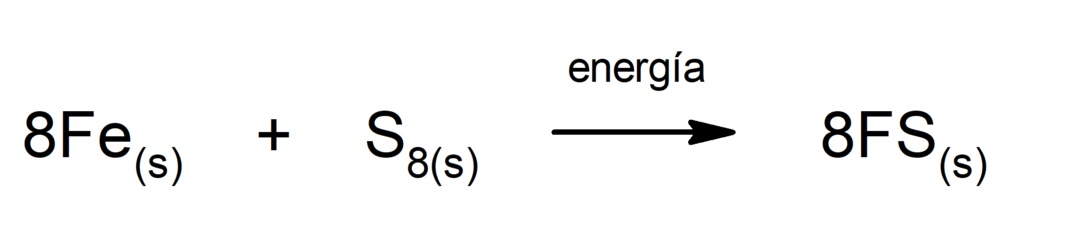
Descompunerea dioxidului de carbon (CO2). Descompunerea CO2 La temperaturi ridicate, produce monoxid de carbon (CO) și oxigen (O2).
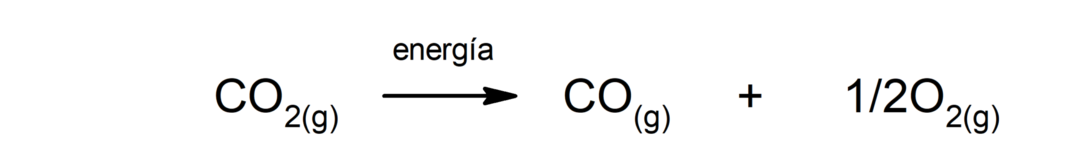
Descompunerea carbonatului de calciu (CaCO3). Carbonatul de calciu se descompune prin absorbția căldurii pentru a produce oxid de calciu (CaO) și dioxid de carbon (CO).2).
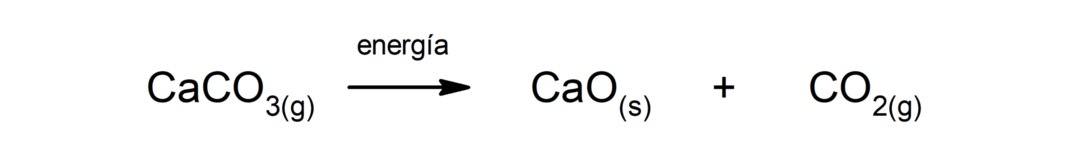
Diferența dintre reacția endotermă și exotermă
Principala diferență dintre reacțiile endoterme și exoterme este că reacțiile endoterme absorb căldură, în timp ce reacțiile exoterme eliberează căldură.
Mai mult, reacțiile endoterme sunt caracterizate de o creștere a entalpiei, în timp ce reacțiile exoterme sunt asociate cu o scădere a entalpiei.
Entalpia este o mărime termodinamică care definește fluxul de energie termică la presiune constantă în timpul unei reacții chimice. Este reprezentată de litera H, iar variația sa este unul dintre principalii indicatori pentru a defini dacă o reacție chimică este endotermă sau exotermă.
- Dacă o reacție chimică are o modificare de entalpie mai mare decât zero (ΔH > 0) este endotermă.
- Dacă o reacție chimică are o modificare de entalpie mai mică decât zero (ΔH < 0) este exotermă.
Urmărește cu:
- Fenomene fizico-chimice
- Chimia în viața de zi cu zi
- Chimia în viața de zi cu zi
- Chimie organică și anorganică
Referințe
- Soto-Córdoba, S. (2016). Reacții endoterme. Depozitul tehnic Institutul Tehnologic din Costa Rica.
- Corominas, J. (2017). Reacții chimice ale vieții de zi cu zi. Alambic, (90), 8-26.
- Sánchez, M. T. M. și Sánchez, M. M. (2002). Studiu experimental al reacțiilor endoterme pentru elevii ESO. Analele de chimie ale RSEQ, (4), 36-39.



