Exemplu de elemente chimice
Chimie / / July 04, 2021
Un element chimic este o substanță pură formată din atomi de același tip, la rândul său format de un număr de protoni și neutroni din nucleu, și o cantitate de electroni în orbitalele lor. Unele se găsesc în mod natural, altele prin formarea moleculelor unui compus, iar altele au fost create prin executarea procedurilor de laborator. Toate elementele chimice alcătuiesc materia întregului univers și susțin existența și funcționarea corpului uman.
Fiecare element are caracteristici și comportamente care îi conferă o distincție și îl fac unic, dar în același timp prezintă asemănări cu un grup de elemente în manifestarea pe care o au în univers. Din acest motiv, există Tabelul periodic al elementelor chimice, care abordează aceste asemănări pentru a grupa în mod coerent elementele și pentru a facilita studierea proprietăților lor.
Numărul atomic al unui element
Atomul poartă în nucleu un număr de protoni, însoțit de același număr de neutroni. La acest număr se numește număr atomic, reprezentat ca
Z în scopuri academice și în literatură. Pentru fiecare element, acest număr va fi unic. Nu există două elemente cu același număr atomic. Tabelul periodic se concentrează, de asemenea, pe acest criteriu pentru ordonarea acestora.Simbolul unui element
În vremurile Alchimiei, care se întind pe aproximativ 400-4000 d.Hr. C., alchimiștii și-au înregistrat experimentele atribuind simboluri elementelor. Erau simboluri simple, realizate cu figuri geometrice, pentru a reprezenta elementul individual și transformările studiate.
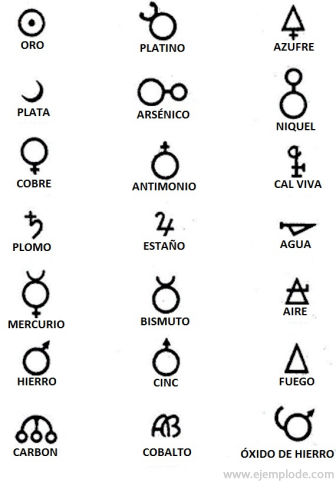
Câteva exemple de simboluri alchimice, cu numele elementului sau compusului pe care l-au reprezentat.
În Era Chimiei Moderne, Elementele sunt încă reprezentate cu simboluri, în acest caz litere care se referă la numele lor în latină sau engleză.
De exemplu:
Simbolul pentru sodiu este N / A, prin numele său latin Natrium
Simbolul aurului este Au, prin numele său latin Aurum
Simbolul pentru Argint este Ag, prin numele său latin Argentum
Simbolul pentru cupru este Cu, prin numele său latin Cuprum
Simbolul Antimoniului este Sb, prin numele său latin Stibium
Simbolul Fierului este Credinţă, prin numele său latin Ferrum
Simbolul lui Mercur este Hg, prin numele său latin Hydrargyrum, care înseamnă „argint lichid”
Simbolul pentru potasiu este K, prin numele său latin Kalium
Grupuri de elemente chimice:
Tabelul periodic al elementelor chimice le clasifică pe grupe: grupele A și grupele B. Grupurile A sunt opt, care conțin elementele Alcalin, Alcalin-Pământos, Terreos, trei familii de Elemente, al căror cap definește numele familiei: Familia Carbon, Familia de azot, Familia de sulf, Halogeni si gaze nobile. Grupurile B sunt alcătuite din toate Metale de tranziție și Pământurile Rare, care sunt, de asemenea, două mari Familii: Lantanide Da Actinide.
Grupa IA: Elemente alcaline:
Seria de elemente alcaline este alcătuită din hidrogen (H), litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs) și franciu (Fr). Toți au o configurație electronică astfel încât în ultima coajă să aibă un electron. Numele său se datorează faptului că atunci când intră în contact cu apa, reacționează formând alcalii sau hidroxizi. Este un comportament general între aceste elemente. Cu cât atomul elementului este mai mare, cu atât este mai reactiv, deoarece forța cu care nucleul reține electronul din ultima coajă are o acoperire din ce în ce mai mică. Sunt capabili să formeze legături ionice cu halogeni. De exemplu: Legătura ionică care are o prezență abundentă este cea a clorurii de sodiu, formând clorură de sodiu NaCI.
Grupa IIA: Elemente alcaline-pământ:
Aceste elemente sunt: Beriliu (Be), Magneziu (Mg), Calciu (Ca), Stronțiu (Sr), Bariu (Ba) și Radiu (Ra). Nu au o natură liberă; pe de altă parte, carbonații și silicații săi există în relativă abundență. Sunt argentinieni albi și cristalini. Se combină ușor cu oxigenul dacă sunt expuși la aer. Acest lucru se datorează, parțial, faptului că au doi electroni în ultima lor coajă, de acord cu capacitatea de recepție a oxigenului. Bariul este cel mai activ element al grupului și, împreună cu calciu, au cele mai multe aplicații industriale din grup.
Grupul IIIA: Elemente ale Pământului:
Grupul IIIA cuprinde elementele Bor (B), Aluminiu (Al), Galiu (Ga), Indiu (In) și Taliu (Tl). Borul este un element nemetalic, aluminiul este amfoteric (amfiprotic), adică este capabil să acționeze ca acid și ca bază; iar celelalte trei sunt elemente metalice. Au trei electroni în ultima lor coajă, generând o valență de +3, deși uneori Galiul acționează cu o valență +1 și +2 în unii dintre compușii săi. Borul este singurul element din această serie care formează hidruri. Borul și aluminiul formează carburi.
Grupa IVA: Familia de carbon:
Elementele reprezentative ale grupului IVA sunt carbonul (C), siliciu (Si), germaniu (Ge), staniu (Sn) și plumb (Pb). Primele două sunt fundamental nemetalice în caracteristicile lor, dar germaniu, staniu și plumb sunt metalice și cu atât mai mult cu cât numărul lor atomic este mai mare. Cu excepția siliconului, fiecare element are valențele +4 și +2.
Carbonul și siliciul formează compuși în care atomii elementelor sunt uniți de perechi de electroni comuni. Carbonul este esența compușilor organici prin asocierea cu atomi de hidrogen, oxigen, azot, sulf și, uneori, siliciu.
Siliciul și germaniu sunt utilizate pentru fabricarea componentelor electronice, deoarece au proprietatea de a se comporta ca semiconductori.
Grupa VA: Familia de azot:
Grupul VA cuprinde elementele Azot (N), Fosfor (P), Arsenic (As), Antimoniu (Sb) și Bismut (Bi). Azotul și fosforul sunt nemetalice, arsenicul și antimoniul sunt metaloizi, iar bismutul este un metal. Aceste elemente se caracterizează prin formarea de hidruri, dintre care cel mai puțin toxic este amoniacul NH3. Azotul formează acidul azotic HNO3, implicat împreună cu acidul clorhidric în Agua Regia, un amestec capabil să dizolve metale prețioase precum aurul și argintul.
Azotul este, de asemenea, implicat în două grupuri mari de compuși organici numiți amine și amide, care pot fi considerați derivați ai amoniacului NH3, prin substituirea unui hidrogen cu un lanț de hidrocarburi.
Grupa VIA: Familia de oxigen:
Alcătuit din elementele oxigen (O), sulf (S), seleniu (Se), telur (Te) și poloniu (Po). Oxigenul este cel mai activ și are capacitatea de a forma cu ușurință legături covalente. În contact cu metalele într-un mediu cu umiditate ridicată, formează oxizi. Formează o moleculă rezonantă numită Ozon, care protejează planeta de radiațiile UV.
Grupa VIIA: Halogeni:
Numele său înseamnă „Formatori de vânzări”. Grupul este format din elementele Fluor (F), Clor (Cl), Brom (Br), Iod (I) și Astat (At). Au șapte electroni în ultima coajă, ceea ce le permite să fie receptori pentru un singur electron. Această calitate îi face să se lege cu elementele grupului IA, formând săruri binare. Fluorul se caracterizează prin faptul că are cea mai mare electronegativitate din întregul tabel periodic, cu o valoare de 4,0, omologul său fiind cesiul, cu electronegativitate de 0,7. Această proprietate îi permite să aibă puterea de a atrage alți atomi și de a da prioritate pentru a forma o legătură cu ei.
Grupa VIIIA: gaze nobile:
Numit și Grupul de gaze inerte, este alcătuit din elementele Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) și Radon (Ra). Ele sunt elementele care au toată configurația lor electronică completă, deci nu sunt capabile să reacționeze în condiții obișnuite. Acestea sunt utilizate în principal pentru semne comerciale luminoase, care emit lumină vizibilă atunci când un curent electric este incident asupra lor.
Grupe B: Metale de tranziție:
În zece grupuri a câte trei elemente, metalele de tranziție sunt grupate. Acestea includ cei mai buni conductori electrici: Argint (Ag), Cupru (Cu), Aur (Au); cele mai bune componente structurale pentru construcții și inginerie urbană; Fier (Fe), Titan (Ti), Aluminiu (Al), Zirconiu (Zr), Tungsten (W); cele mai bune componente ale catalizatorului: nichel (Ni), vanadiu (V), platină (Pt); și principalele ingrediente de acoperire: cadmiu (Cd), crom (Cr), zinc (Zn). De obicei tratează valențe între +1 și +3, dar elemente precum Crom tratează valențe +2, +3, +6.
Pământuri rare: Lantanide și Actinide:
Acestea sunt numite Pământuri Rare din cauza penuriei lor pe planetă. Acestea sunt alcătuite din două grupuri: Lantanide și Actinide. Acestea se găsesc pe cele două linii separate ale Tabelului periodic. În general, funcționează cu o valență de +3 și tind să formeze hidroxizi. Cel mai important element dintre acestea este ceriul, care este utilizat la prepararea aliajelor piroforice (aliaj Mischmetal, pentru pietre pentru brichete), în furtunuri de gaz pentru iluminat și la fabricarea de ochelari speciali care absorb razele ultraviolete și radiațiile de căldură.
Cele mai puternice elemente radioactive, precum uraniul (U) și plutoniul (Pu), fac parte din aceste grupuri. care, având în vedere instabilitatea lor, eliberează energie și se dezintegrează, pierzând particule alfa (nuclei de Heliu). Mai târziu, ele devin elemente mai puțin instabile, conform seriei radioactive.