Exemplul legii lui Dalton
Chimie / / July 04, 2021
Savantul englez John Dalton (1766-1844) a fost un fizician și chimist care a adus numeroase contribuții la compresia și clasificarea elementelor și a substanțelor chimice. Printre contribuțiile sale principale se numără primul model de reprezentare a atomilor și compușilor printr-o reprezentare grafică. De asemenea, el a formulat așa-numita „Legea proporțiilor multiple”, cunoscută și sub numele de Legea lui Dalton.
Despre combinațiile chimice, Louis Proust (1754-1826) a formulat „Legea proporțiilor constante”, în care colectează observația că substanțele chimice se combină întotdeauna în aceeași proporție pentru a produce aceiași compuși. Adică, dacă hidrogenul și oxigenul sunt combinate, acestea se vor combina întotdeauna în aceleași proporții, pentru a produce apă. Cu toate acestea, această lege nu a explicat cum existau diferiți compuși compuși din aceleași substanțe.
Cu teoria sa atomică, Dalton a realizat că atunci când unele substanțe simple sunt combinate, ele pot se produc diferiți compuși și cantitățile uneia dintre substanțe variază proporțional simplu.
Legea lui Dalton este enunțată astfel: Greutățile unui element care se unesc cu aceeași cantitate de altul pentru a forma diferiți compuși chimici variază în funcție de o relație foarte simplă.
Aceasta înseamnă că, dacă știm cum se combină substanțele în proporții simple, iar cantitatea uneia dintre substanțe rămâne constantă și alta substanță pe care o punem într-o proporție simplă, ca raport de 2, 3 sau 4 în raport cu proporția inițială, în fiecare caz vom obține o substanță diferit. Acest lucru se întâmplă, de exemplu, atunci când combinați fosfor, hidrogen și oxigen.
Dacă combinăm 1 volum de fosfor, 3 volume de hidrogen și 2 volume de oxigen, vom obține acid hipofosforic:
P + 3H + 2O -> PO2H3
Dacă în reacția anterioară vom varia doar oxigenul într-o proporție simplă de 2, vom obține acid fosforic:
P + 3H + 4O -> PO4H3
Trebuie luat în considerare faptul că, în acest moment, conceptul de valență atomică nu era încă cunoscut, deci nu se știa exact de ce unele substanțe puteau fi combinate în proporții variabile și altele nu.
Exemplul legii lui Dalton
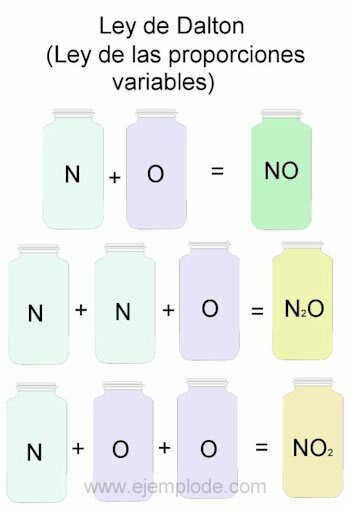
Pentru a exemplifica legea lui Dalton, vom lua ca referință combinațiile de azot (N) și oxigen (O).
Când sunt combinate în aceeași proporție, adică unul câte unul, vom obține oxid nitric:
N + O -> NU
Dacă menținem constant volumul de azot și modificăm oxigenul cu 2, vom obține peroxid de azot:
N + 2O -> NR2
Dacă pe baza oxidului azotic, păstrăm acum oxigenul constant și modificăm volumul de azot cu 2, vom obține oxid azotat:
2N + O -> N2SAU
Dacă articolul ți-a fost util, nu uita să ne dai un +1.
