Exemplu de legătură peptidică
Chimie / / July 04, 2021
Legătură peptidică este cel în care două molecule de aminoacizi sunt unite prin condensare.
Pentru a înțelege mai bine legăturile peptidice, trebuie să se definească mai întâi aminoacizii:
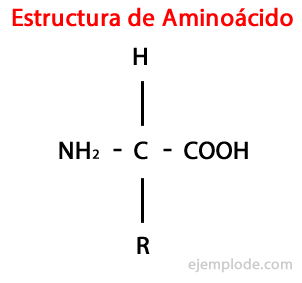
Aminoacizii sunt molecule organice scurt care conține cel puțin o grupare amino (-NH2), de natură alcalină, și o grupă carboxil (-COOH), cu caracter acid.
Deși ființele vii sintetizează, în diferite scopuri, tipuri foarte diverse de aminoacizi, cele mai importante sunt cele care fac parte din proteine, toate acestea aparțin clasei α-aminoacizi.
A-aminoacizii sunt caracterizați prin faptul că au grupările acide și amino atașate la același atom de carbon, numit α Carbon. Mai mult, acest carbon α se leagă, ca al treilea substituent, un atom de hidrogen și, ca un al patrulea substituent, un grup suplimentar de dimensiuni și caracteristici diverse, care diferențiază fiecare aminoacid de alții.
Al patrulea substituent se numește Lanț lateral a aminoacidului și este adesea reprezentat în formă simplificată de litera R.
Deoarece cei patru substituenți ai α-carbonului sunt diferiți și adoptă un aranjament tetraedric în jurul său, α-aminoacizii prezenți izomerism optic, care este atunci când o moleculă are o formă alternativă care arată ca un imagine in oglinda lui, care în cele din urmă nu este o moleculă egală. Aceste două forme izomerice ale moleculei sunt atribuite literele D sau L, în funcție de modul în care substituenții sunt dispuși în spațiu. Toți aminoacizii din proteine sunt L.
Aminoacizii sunt clasificați în funcție de caracterul lor chimic în Polar și Apolar. Polarii la rândul lor sunt împărțiți în Neutru și încărcat (care poate fi acid sau bazic). Nonpolarul poate fi alifatic sau aromatic.
Peptidele și legătura peptidică
Peptidele sunt produsul unirii covalente a aminoacizilor prin legături amidice, formându-se prin condensarea capătului Carboxil al unuia și al capătului amino al celuilalt, eliberând o moleculă de apă în reacţie. Această uniune se numește legătură peptidică.
Mecanismul acestei reacții este prezentat mai jos, în care Grupuri de amino și carboxil, iar condensarea moleculelor de aminoacizi apare pentru a forma peptida.
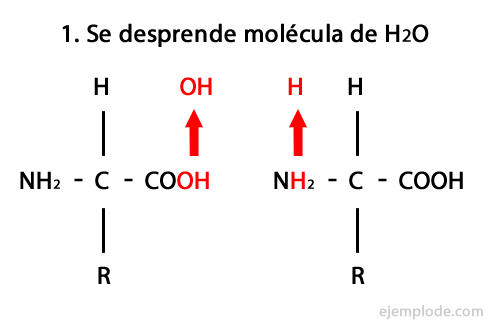
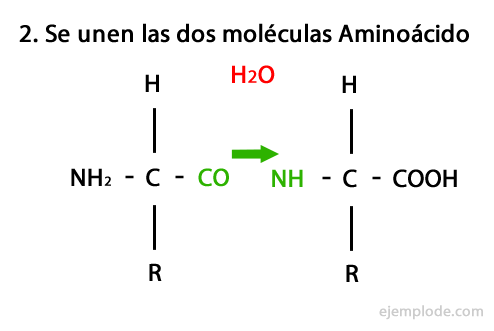

Peptidele, cum ar fi aminoacizii și proteinele, au o grupare amino și o grupă carboxil la capetele lor fără să reacționeze.
Pentru a specifica formula unei peptide simple și chiar a unei proteine, este suficient să enumerăm aminoacizii care o compun, începând cu cel cu un grup Amino gratuit, și se termină cu cel cu grupul său Carboxyl gratuit.
Unele peptide găsite în organism sunt Vasopresina, care crește tensiunea arterială și crește reabsorbția apei în rinichi; Encefalină, care reduce senzația de durere; si Oxitocina, care determină contractarea uterului.
Caracteristicile legăturii peptidice
Condensarea grupului amino al unui aminoacid cu carboxilul altuia, are loc în solvent apos, astfel încât nu este spontanși, prin urmare, sinteza proteinelor necesită un aport de energie.
Legătura peptidică, ca în orice legătură amidică, prezintă rezonanță între două forme extreme: forma neutră, cu o singură legătură care unește carbonul carbonilic al primului aminoacid și amino azotul celui de-al doilea (C-N) și formularul cu separarea taxelor în care cei doi atomi sunt legați printr-o dublă legătură (C = N). În realitate, legătura peptidică nu adoptă niciuna dintre cele două situații extreme, ci este un hibrid rezonant al ambelor.
Există apelul Planul peptidic, constând din toți atomii implicați în legătura peptidică, care unesc cei doi aminoacizi inițiali. Pe de o parte, atomii de azot și hidrogen, cu carbonul lor respectiv α în primul aminoacid. Pe de altă parte, carbonul α al celuilalt aminoacid, cu oxigenul și carbonul grupării carbonil.
Diferențele dintre peptide și proteine
peptidele au un număr redus de aminoacizi, care variază de la două la câteva zeci dintre ele, iar conformația lor în soluție devine flexibilă.
proteine mici, apropiate structural de peptidele mari, au o conformație definită și mult mai puțin flexibilă.
Există proteine care, ca și peptidele, au o conformație dezordonată și flexibilă, dar care se ordonează atunci când interacționează cu alte macromolecule din celulă.
20 de exemple de aminoacizi care participă la legarea peptidelor
- Wisteria
- Fetei
- Valine
- Leucina
- Isoleucina
- Proline
- Metionină
- Fenilalanină
- Tirozină
- Triptofan
- Serine
- Treonina
- Cisteina
- Asparagine
- Glutamina
- Acid aspartic
- Acid glutamic
- Lizină
- Arginina
- Histidină



