Exemplu de baze chimice
Chimie / / July 04, 2021
În chimie generală, Bazele sunt o categorie de produse chimice care îndeplinesc mai multe funcții:
-Reacționează cu acizi într-o neutralizare, producând o sare și apă.
-Reglați potențialul de hidrogen, pH-ul, ridicându-i valoarea, dacă sunt turnate în mijlocul unde se găsește o reacție.
-Run as as Reactivi chimici pentru un număr mare de reacții.
Bazele pot fi specii diferite, ambele Chimie anorganică începând cu Chimie organica, Ca Hidroxizi, Amine si Alcooli, de exemplu.
Pentru a defini comportamentul bazelor, sunt utilizate cele trei teorii principale ale acidului-bază: Arrhenius, Brönsted-Lowry și Lewis.
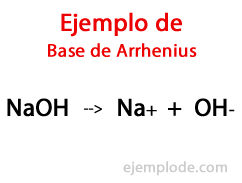
Bazele după Arrhenius
Potrivit chimistului suedez Svante Arrhenius, Bazele sunt acele substanțe chimice care furnizează ioni hidroxil (OH-) la un mediu de reacție, mai ales dacă este o soluție apoasă. Astfel, cu ionii hidroxil disponibili, va exista un PH alcalin, adică cu o valoare mai mare de 7 și până la 14 în funcție de câtă bază este prezentă în momentul măsurării.
Aceasta este una dintre cele mai simple și practice teorii de aplicat, deoarece nu are complicații pentru a diferenția substanțele care iau parte la reacție. Este bine cunoscut care este acidul și care este baza.
În cadrul acestei teorii, există indiscutabil hidroxizi anorganici, cum ar fi hidroxidul de sodiu (NaOH) și hidroxidul de potasiu (KOH).
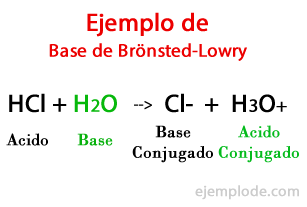
Bazele conform lui Brönsted-Lowry
Conform teoriei formulate de danezi Johannes Brönsted și britanicii Thomas Martin Lowry, o bază este o specie chimică capabil să primească protonii pe care un altul, acidul, îi va da în timpul unei reacții chimice. Protonul este în general legat de sarcina pozitivă care îl caracterizează, așa că îl putem asocia din nou cu ionii de hidrogen (H +).
Când schimbul are loc în reacția chimică, produsele se numesc: "Conjugated Acid Base" și "Conjugated Acid Base", pe baza reactanților care i-au format.
Pentru această teorie, Amoniac (NH3) este cel mai reprezentativ caz. Pentru Brönsted și Lowry, substanțele care sunt capabile să rețină ionii de hidrogen (H +) sunt Bazele. În acest caz, amoniacul, comportându-se ca o bază, va dobândi un hidrogen în structura sa, consolidându-se ca ion de amoniu (NH4+), cu excesul de sarcină pozitivă a hidrogenului. Amoniul este acidul conjugat al amoniacului.
Amine, compuși organici derivați din amoniac (NH3), cum ar fi amina metilică (CH3NH2), atunci când sunt în soluție, se comportă ca baze și sunt capabili să primească sarcini pozitive în structura lor, fie de la hidrogen, fie de la carbocație.
Un carbocație este un ion organic format ca un lanț de hidrocarburi, care, în absența unui ion negativ, care Poate fi hidroxil (OH-) sau un halogen (Cl-, Br-), tinde să se lege de un loc care îl poate primi, care va fi Baza.
Bazele conform lui Lewis
Omul de știință american Gilbert Lewis a subliniat în teoria sa acid-bază că bazele sunt acele substanțe care sunt capabile să-și contribuie perechile de electroni liberi pentru ca altul să-și completeze octetul.
Această teorie a acidului-bază este un complement pentru a reafirma validitatea regulii octetului, în care descrie cum atomii dobândesc stabilitate atingând un număr de opt electroni în ultima lor coajă, folosind Bond Covalent
Ionul hidroxil este un bun exemplu de bază Lewis. Are o pereche de electroni liberi pe care poate ajunge un ion de hidrogen care nu are electroni. Se va forma o moleculă de apă. Așa se va forma octetul pentru oxigenul moleculei, iar hidrogenii, care sunt atomi mai mici, vor avea perechea lor de electroni care îi vor stabiliza.

Utilizări ale bazelor importante
Hidroxid de sodiu NaOH Este, în general, utilizat în soluție apoasă pentru curățarea grăsimilor solidificate în sobele domestice și industriale, dizolvându-l eficient. De asemenea, este utilizat, în soluție concentrată, atunci când apar deversări neprevăzute ale unei substanțe acide, pentru a o neutraliza.
Hidroxid de magneziu Mg (OH)2 Este utilizat într-o soluție numită „Lapte de magnezie”, pentru a rezolva arsurile la stomac, neutralizându-l. Se vinde în farmacii.
Hidroxid de potasiu KOH Este folosit ca reactiv pentru procesele de saponificare, transformând grăsimile în săpun.
Amoniac NH3 Este utilizat în forma sa gazoasă ca agent frigorific industrial, în special la producătorii de gheață. Este foarte periculos de utilizat, deoarece respirația unei concentrații de 5 miligrame pe litru în aer poate fi fatală.
Exemple de baze chimice
Apă H2SAU
Amoniac NH3
Hidroxid de sodiu NaOH
Hidroxid de potasiu KOH
Hidroxid de magneziu Mg (OH)2
Hidroxid de calciu Ca (OH)2
Hidroxid de aluminiu Al (OH)3
Hidroxid de amoniu NH4Oh
Hidroxid de fier Fe (OH)2
Hidroxid feric Fe (OH)3
Hidroxil Ion (OH-)
Ion clorură (Cl-)
Ion bromură (Br-)



