Exemplu de compuși aromatici
Chimie / / July 04, 2021
Chimiștii au găsit utilă împărțirea tuturor compușilor organici în două clase mari: compuși Alifatic și compuși Aromatice. Compușii aromatici sunt benzenul și compușii cu comportament chimic similar. Proprietățile aromatice sunt cele care disting Benzenul de Hidrocarburile Alifatice. Molecula de benzen este un inel de un anumit tip. Există și alți compuși, de asemenea în formă de inel, care par să difere structural de benzen și totuși se comportă în mod similar.
Se pare că acești alți compuși seamănă cu benzenul în structura lor electronică de bază, motiv pentru care se comportă și ca aromatici.
Hidrocarburile alifatice (alcani, alchene, alchine și analogii lor ciclici) reacționează în principal prin plus, în mai multe linkuri și de substituirea radicalilor liberi, în alte puncte ale lanțului alifatic.
Pe de altă parte, hidrocarburile aromatice, se subliniază faptul că au tendința de a substituție heterolitică. Mai mult, aceleași reacții de substituție sunt caracteristice inelelor aromatice oriunde apar, indiferent de ce alte grupe funcționale ar putea conține molecula. Aceste ultime grupuri afectează reactivitatea inelelor aromatice și invers.
Molecula de benzen
Benzenul este cunoscut din 1825, iar proprietățile sale chimice și fizice sunt mai cunoscute decât cele ale oricărui alt compus organic. În ciuda acestui fapt, abia în 1931 a fost propusă o structură satisfăcătoare pentru aceasta substanță și a durat până la 15 ani pentru ca acesta să fie utilizat în general printre substanțele chimice organic. Dificultatea rezidă în limitele dezvoltării pe care teoria structurală o atinsese până atunci. Structura finală a fost atinsă datorită asumării mai multor fapte importante:
Benzenul are formula moleculară C6H6. Datorită compoziției sale elementare și a greutății moleculare, se știa că benzenul avea șase atomi de carbon și șase atomi de hidrogen. Problema era cunoașterea aranjamentului acestor atomi.
În 1858, August Kekulé a propus ca atomii de carbon să poată fi legați împreună pentru a forma lanțuri. Mai târziu, în 1865, a oferit un răspuns la problema benzenului: aceste lanțuri carbonatice pot fi uneori închise, pentru a forma inele.
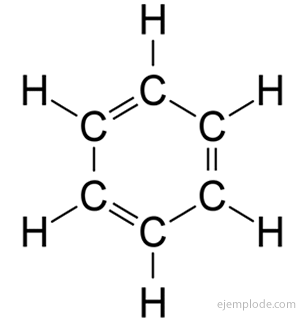
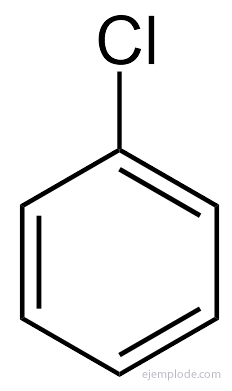
Benzenul dă doar un produs C monosubstituit6H5Da. De exemplu, atunci când un atom de hidrogen este înlocuit cu brom, se obține doar o singură configurație de BromoBenzen C.6H5Br; în mod analog, un clorbenzen C6H5Cl sau un nitroBenzen C6H5NU2, etc. Acest fapt impune o limitare severă a structurii benzenului: tot hidrogenul său trebuie să fie exact echivalent, adică trebuie să fie toți uniți cu carbonii care la rândul lor sunt toți egali legat. Nu poate exista hidrogen în CH3, și alții în CH2, și alții în CH. Structura finală a monosubstituitului ar trebui să fie aceeași pentru înlocuirea oricărui hidrogen din benzen.
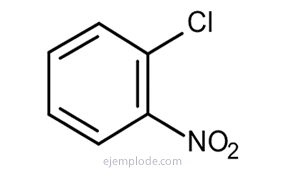
Benzenul dă trei produse izomerice disubstituite, C6H4Da2 sau C6H4ȘI Z. Există doar trei DiBromoBenzeni izomeri, C6H4Fr2, trei cloroNitroBenzeni C6H4ClNO2, etc. Acest fapt limitează și mai mult posibilitățile structurale.
Benzenul suferă reacții de substituție, mai degrabă decât reacții de adăugare. Structura benzenică a lui Kekulé corespunde cu una pe care am numi-o ciclohexatrienă. Din această cauză, ar trebui să reacționeze cu ușurință prin adăugare, la fel ca și compușii similari, ciclohexadiena și ciclohexena, care este o caracteristică a structurii alchenelor. Dar nu este cazul; în condiții în care alchenele reacționează rapid, benzenul nu reacționează sau doar foarte lent. În loc de reacții de adăugare, benzenul suferă cu ușurință un set de reacții, toate acestea fiind substituţie, dupa cum Nitrarea, Sulfonare, Halogenare, Alchilare Friedel-Crafts, Acilare din Friedel-Crafts. În fiecare dintre aceste reacții, un atom sau grup a fost înlocuit cu unul dintre atomii de hidrogen ai benzenului.
Stabilitatea benzenului se datorează legăturilor duble alternante și, de asemenea, energiei de rezonanță, în cea în care legăturile duble își schimbă poziția între carboni, menținând aceeași alternanță structural. Este energie de stabilizare a rezonanței este responsabil pentru setul de proprietăți numit Proprietăți aromatice.
O reacție de adiție transformă o alchenă într-un compus saturat mai stabil. Dar, în cazul benzenului, un adaos îl face mai puțin stabil prin distrugerea sistemului inelar susținut și stabilizat prin rezonanță. Molecula finală ar fi Ciclohexadiena. Datorită acestui fapt, stabilitatea benzenului îl conduce la reacții de substituție.
Proprietățile compușilor aromatici
Pe lângă substanțele care conțin inele de benzen, există multe altele care sunt considerate aromatice, deși la suprafață nu au nici o asemănare cu benzenul.
Din punct de vedere experimental, compușii aromatici sunt substanțe ale căror formule moleculare sugerează a grad ridicat de nesaturare, în ciuda faptului că sunt rezistent la reacțiile de adiție atât de caracteristic compușilor nesaturați.
În schimb, acești compuși aromatici a deseori suferă reacții de substituție electrofilă asemănătoare cu cele ale benzenului. Împreună cu această rezistență la adăugare și probabil din cauza ei, există dovezi ale unui stabilitate neobișnuită, cum ar fi căldurile reduse de hidrogenare și combustie.
Substanțele aromatice sunt ciclice, prezentând de obicei inele de cinci, șase și șapte atomi, iar examinarea lor fizică arată că au molecule plate sau aproape plate. Protonii săi au același tip de schimbare chimică în spectrele de rezonanță magnetică nucleară ca și în benzen și derivatele sale.
Din punct de vedere teoretic, pentru ca o substanță să fie aromată, molecula sa trebuie să aibă nori ciclici de electroni π delocalizați deasupra și sub planul moleculei; Mai mult, acești nori π trebuie să conțină în total (4n + 2) π electroni; aceasta înseamnă că delocalizarea nu este suficientă pentru a rezulta stabilitatea specială care caracterizează un compus aromatic.
Nomenclatura derivaților de benzen (compuși aromatici)
În cazul multora dintre acești derivați, în special în cei monosubstituiți, este suficient să puneți grup substituent pentru cuvântul Benzen, cum ar fi, de exemplu, ClorBenzen, BromoBenzen, IodoBenzen, Nitrobenzen.
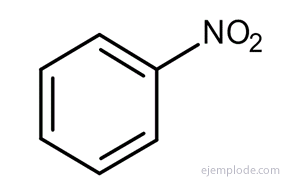
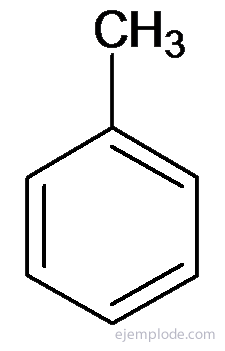
Alți derivați au nume speciale care pot să nu aibă similitudine cu numele grupului substituent. De exemplu, metil benzenul este cunoscut doar sub numele de toluen; AminoBenzen ca anilină; Hidroxibenzen ca fenol etc.
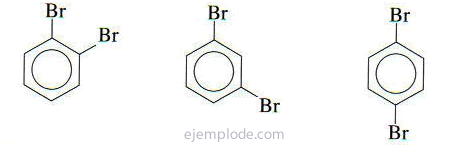
Dacă există două grupuri atașate la inelul benzenic, este necesar nu numai să se identifice ceea ce sunt, ci și să se indice locația lor relativă. Cei trei izomeri posibili pentru benzenii disubstituiți se caracterizează prin prefixele orto, meta și para, prescurtate o-, m-, p-. De exemplu: o-DiBromoBenzen, m-DiBromoBenzen, p-DiBromoBenzen.
Dacă una dintre cele două grupuri este de tipul care dă moleculei un nume special, compusul este numit ca derivat al acelei substanțe speciale. De exemplu: NitroToluen, Bromofenol etc.
Exemple de compuși aromatici
Toluen sau Metilbenzen
Etilbenzen
Izopropilbenzen
TriNitroToluene sau TNT
Anilina sau Aminobenzenul
Acid benzoic
Acid glutamic sau acid ParaAminoBenzoic
Acid sulfonic toluenic
Fenol sau hidroxibenzen
Bromofenol
Trichloro benzen
Benzen fenil eter
Benzen de iod
Bromo benzen



